Зміна внутрішньої енергії при ізотермічному процесі
У фізиці ідеальних газів під внутрішньою енергією розуміють кінетичну енергію, пов’язану з обертальним та поступальним рухом молекул. З кінетичної теорії нескладно отримати наступну формулу для внутрішньої енергії U:
U = z / 2 * n * R * T.
Де z – це число ступенів вільного руху молекул. Воно змінюється від 3 (одноатомний газ) до 6 (багатоатомні молекули).
У випадку ізотермічного процесу температура залишається постійної, значить, єдиною причиною зміни внутрішньої енергії є вихід або прихід в систему частинок речовини. Таким чином, у закритих системах під час ізотермічного зміни їх стану внутрішня енергія зберігається.
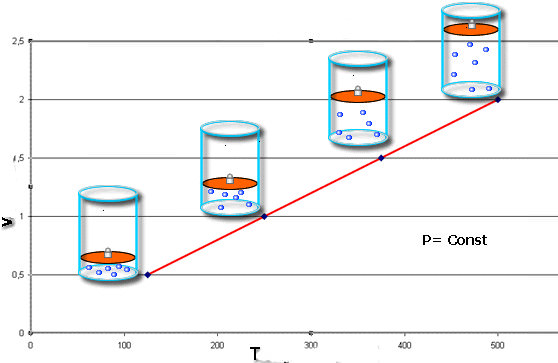
Ізобарний і ізохорний процеси
Крім закону Бойля-Маріотта, існують ще два основних газових закону, які також були відкриті експериментальним шляхом. Вони носять прізвища французів Шарля і Гей-Люссака. Математично їх записують так:
V / T = const при P = const;
P / T = const при V = const.
Закон Шарля говорить про те, що під час изобарного процесу (P = const) обсяг лінійно залежить від абсолютної температури. Закон Гей-Люссака свідчить про лінійної залежності між тиском і абсолютною температурою при изохорном переході (V = const).
З наведених рівностей випливає, що від ізотермічного процесу графіки изобарного і ізохорний переходів відрізняються істотним чином. Якщо ізотерма має форму гіперболи, то изобар і изохора є прямими лініями.