Ізотермічний процес
Незалежно від того, відбувається цей процес в газах, рідинах або твердих тілах, він має цілком чітке визначення. Ізотермічним називається такий перехід між двома станами, при якому температура системи зберігається, тобто залишається незмінною. Тому графіком ізотермічного процесу в осях часу (вісь x) – температури (вісь y) буде горизонтальна лінія.
Щодо ідеального газу зазначимо, що ізотермічний перехід для нього називається законом Бойля-Маріотта. Виявлений цей закон був експериментальним шляхом. Причому він став першим в цій області (друга половина XVII століття). Його може отримати кожен школяр, якщо розгляне поведінку газу в закритій системі (n = const) при постійній температурі (T = const). Користуючись рівнянням стану, отримуємо:
n * R * T = const =>
P * V = const.
Останнє рівність являє собою закон Бойля-Маріотта. У підручниках з фізики можна також зустріти таку форму запису:
P1 * V1 = P2 * V2.
При переході з ізотермічного стану 1 в термодинамічне 2 добуток об’єму на тиск залишається постійним для закритої газової системи.
Досліджуваний закон говорить про обернену пропорційність між величинами P і V:
P = const / V.
Це означає, що графік ізотермічного процесу в ідеальному газі буде крива гіпербола. Три гіперболи зображені на малюнку нижче.
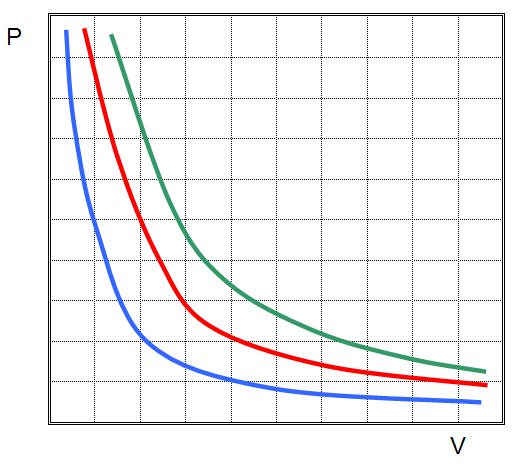
Кожна з них називається ізотермою. Чим вище температура в системі, тим далі від осей координат буде стояти ізотерма. З малюнка вище можна зробити висновок, що зелена відповідає самій високій температурі в системі, а синя – найнижчою за умови, що кількість речовини в усіх трьох системах є однаковим. Якщо ж все ізотерми на малюнку побудовані для однієї температури, то це означає, що зелена крива відповідає найбільшою в плані кількості речовини системі.