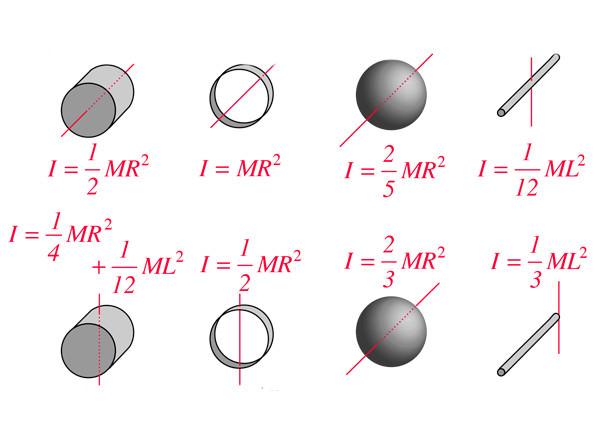Головним предметом вивчення термодинаміки газових систем є зміна термодинамічних станів. В результаті таких змін газ може здійснювати роботу і запасати внутрішню енергію. Вивчимо у наведеній нижче статті різні термодинамічні переходи в ідеальному газі. Особливу увагу буде приділено вивченню графіка ізотермічного процесу.
Ідеальні гази
Вже судячи з самої назви, можна сказати, що 100-відсоткових ідеальних газів в природі не існує. Однак багато реальні речовини задовольняють цієї концепції з прийнятною для практики точністю.
Ідеальним називається будь-який газ, в якому можна знехтувати взаємодіями між його частинками і їх розмірами. Обоє умови задовольняються тільки в тому випадку, якщо кінетична енергія молекул буде набагато перевищувати потенційну енергію зв’язків між ними, а відстані між молекулами набагато більше розмірів частинок.
Щоб визначити, чи є досліджуваний газ ідеальним, можна скористатися простим емпіричним правилом: якщо температура в системі вище кімнатної, тиск не сильно відрізняється від атмосферного або менше за нього, а складові систему молекули є хімічно інертними, то газ буде ідеальним.