Закон Шарля і Гей-Люссака
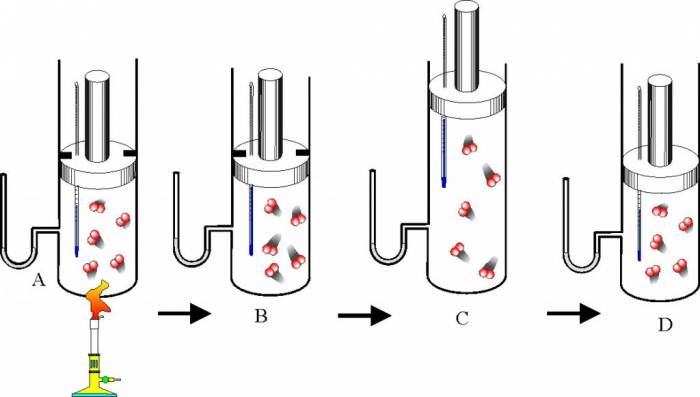
У 1787 році французький вчений Шарль і в 1803 році інший француз Гей-Люссак емпіричним шляхом встановили ще один закон, який описував поведінка ідеального газу. Його можна сформулювати так: в закритій системі при постійному тиску газу збільшення температури приводить до пропорційного збільшення обсягу і, навпаки, зменшення температури веде до пропорційного стиску газу. Математична формулювання закону Шарля і Гей-Люссака записується так:
V / T = k2 при P = const.
Перехід між станами газу зі зміною температури та об’єму і при збереженні тиску в системі називається изобарным процесом. Константа k2 визначається значенням тиску в системі і масою газу, але не його хімічною природою.
На графіку функція V (T) являє собою пряму лінію з тангенсом кута нахилу k2.
Зрозуміти цей закон можна, якщо залучити положення молекулярно-кінетичної теорії (МКТ). Так, збільшення температури призводить до збільшення кінетичної енергії газових частинок. Останнє сприяє підвищенню інтенсивності їх зіткнень зі стінками посудини, що збільшує тиск в системі. Щоб це тиск зберегти постійним, необхідно об’ємне розширення системи.