Газ є одним з чотирьох агрегатних станів навколишнього нас матерії. Це стан речовини людство почало вивчати із застосуванням наукового підходу, починаючи з XVII століття. У наведеній нижче статті вивчимо, що таке ідеальний газ, і рівняння, яке описує його поведінку при різних зовнішніх умовах.
Поняття про ідеальному газі
Кожна людина знає, що повітря, яким ми дихаємо, або природний метан, який ми використовуємо для обігріву будинків і приготування їжі, це яскраві представники газового стану матерії. У фізиці для вивчення властивостей цього стану було введено поняття ідеального газу. Це поняття передбачає використання низки припущень і спрощень, які не є суттєвими при описі базових фізичних характеристик речовини: температури, об’єму і тиску.
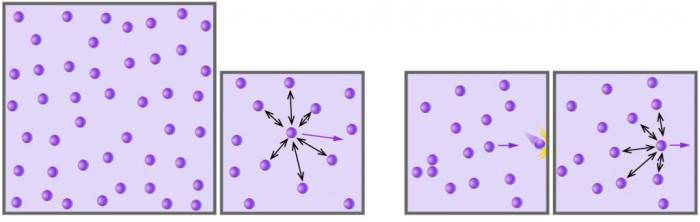
Отже, ідеальним газом називається рідка субстанція, яка задовольняє наступні умови:
Сукупність викладених умов відповідає поняттю ідеального газу. Всі відомі реальні речовини з високою точністю відповідають введеній концепції при високих температурах (кімнатної і вище) і низьких тисках (до атмосферного і нижче).