Рівняння Пуассона для адіабатичного процесу

Перший закон термодинаміки записується в такому вигляді:
Q = ΔU + A.
Іншими словами, повідомлена системі теплота Q йде на виконання системою роботи A і на підвищення її внутрішньої енергії ΔU. Щоб написати рівняння адіабати, слід покласти Q=0, що відповідає визначенню досліджуваного процесу. Отримуємо:
ΔU = -A.
При изохорном процесі в ідеальному газі все тепло йде на підвищення внутрішньої енергії. Цей факт дозволяє записати рівність:
ΔU = CV*ΔT.
Де CV – изохорная теплоємність. Робота A, в свою чергу, обчислюється так:
A = P*dV.
Де dV – мале зміна обсягу.
Крім рівняння Клапейрона-Менделєєва, для ідеального газу справедливо наступне рівність:
CP – CV = R.
Де СР – ізобарна теплоємність, яка завжди більше изохорной, так як вона враховує втрати газу на розширення.
Аналізуючи записані вище рівності і проводячи інтегрування по температурі і обсягом, приходимо до наступного рівняння адіабати:
T*Vγ-1 = const.
Тут γ – показник адіабати. Він дорівнює відношенню изобарной теплоємності до изохорной. Це рівняння називається рівнянням Пуассона для адіабатичного процесу. Застосовуючи закон Клапейрона-Менделєєва, можна записати ще два аналогічні вирази, тільки вже через параметри P-T і P-V:
T*Pγ/(γ-1) = const;
P*Vγ = const.
Графік адіабати можна привести в різних осях. Нижче він показаний в осях P-V.
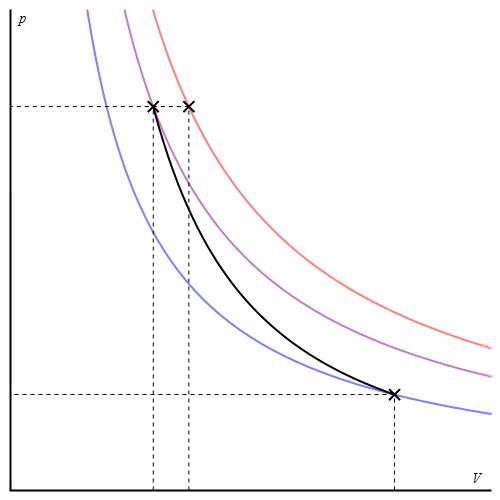
Кольорові лінії на графіку відповідають ізотермами, чорна крива – це адіабата. Як видно, адіабата веде себе більш різко, ніж будь-яка з ізотерм. Цей факт просто пояснити: для ізотерми тиск змінюється обернено пропорційно обсягу, для ізобати ж тиск змінюється швидше, оскільки показник γ>1 для будь-якої газової системи.