Рівняння стану ідеального газу
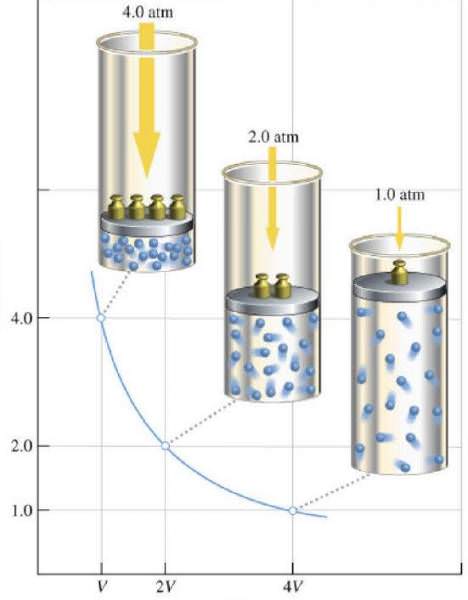
Бойля-Маріотта, закон приватним випадком більш загального закону, який носить прізвища Менделєєва і Клапейрона. Еміль Клапейрон, узагальнюючи експериментальну інформацію поведінки газів при різних зовнішніх умовах, в 1834 році отримав наступне рівняння:
P*V = n*R*T
Іншими словами, твір обсягу V газової системи на тиск P в ній прямо пропорційно добутку абсолютної температури T на кількість речовини n. Коефіцієнт цієї пропорційності позначений буквою R і називається універсальної газової сталої. У записаному рівнянні величина R з’явилася завдяки заміні ряду констант, яку зробив Дмитро Іванович Менделєєв в 1874 році.
З універсального рівняння стану легко побачити, що постійність температури і кількості речовини гарантує незмінність правій частині рівності, а отже, ліва частина рівності також буде залишатися постійною. У такому разі ми отримуємо рівняння Бойля-Маріотта.