Інші газові закони
Записане в пункті вище Клапейрона-Менделєєва рівняння містить три термодинамічних параметрів: P, V і T. Якщо кожен з них фіксувати, а двом іншим дозволяти змінюватися, то ми отримаємо рівняння Бойля-Маріотта, Шарля і Гей-Люссака. Шарля закон говорить про прямий пропорційності між об’ємом і температурою для изобарного процесу, а Гей-Люссака, закон стверджує, що в разі ізохорний переходу тиск газу зростає або зменшується абсолютній температурі прямо пропорційно. Відповідні рівняння виглядають так:
V/T = const при P = const;
P/T = const при V = const.
Таким чином, Бойля-Маріотта, закон є одним з трьох основних газових законів. Тим не менш він відрізняється від інших в плані графічної залежності: функції V(T) і P(T) є прямими лініями, функція P(V) – це гіпербола.
Приклад задачі на застосування Бойля-Маріотта закону
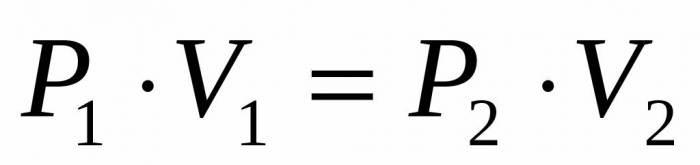
Обсяг газу в циліндрі під поршнем в початковому положенні становив 2 літри, і його тиск було одно 1 атмосфера. Чому стало одно тиск газу після того, як поршень піднявся, і обсяг газової системи збільшився на 0,5 літра. Процес вважати ізотермічним.
Оскільки нам дано тиск і об’єм ідеального газу, а також відомо, що температура в процесі його розширення залишається незмінною, то ми вправі скористатися рівнянням Бойля-Маріотта у наступній формі:
P1*V1 = P2*V2
Це рівність говорить про те, що твір на обсяг тиску є постійним для кожного стану газу при даній температурі. Висловлюючи рівності величину P2, отримуємо кінцеву формулу:
P2 = P1*V1/V2
При виконанні обчислень тиску можна використовувати позасистемні одиниці в даному випадку, оскільки літри скоротяться, і ми отримаємо тиск P2 в атмосферах. Підставивши дані з умови, приходимо до відповіді на питання завдання: P2 = 0,8 атмосфери.












