Вивчення властивостей ідеального газу є важливою темою у фізиці. Знайомство з характеристиками газових систем починають з розгляду рівняння Бойля-Маріотта, оскільки воно є першим експериментально виявлених законом ідеального газу. Розглянемо його докладніше в статті.
Що розуміють під ідеальним газом?
Перш ніж говорити про закон Бойля-Маріотта і рівнянні, що його описує, дамо визначення ідеального газу. Під ним прийнято розуміти текучу субстанцію, в якій складові її частки одна з одною не взаємодіють, та їх розміри пренебрежимо малі в порівнянні з середніми межчастичными відстанями.
Насправді будь-який газ є реальним, тобто складові її атоми і молекули мають певний розмір і між собою з допомогою Ван-дер-ваальсових сил не взаємодіють. Однак, при високих абсолютних температур (більше 300 К) і низьких тисках (менше однієї атмосфери) кінетична енергія атомів і молекул значно перевищує енергію Ван-дер-ваальсових взаємодій, тому реальний газ при зазначених умовах з високою точністю може вважатися ідеальним.
Рівняння Бойля-Маріотта
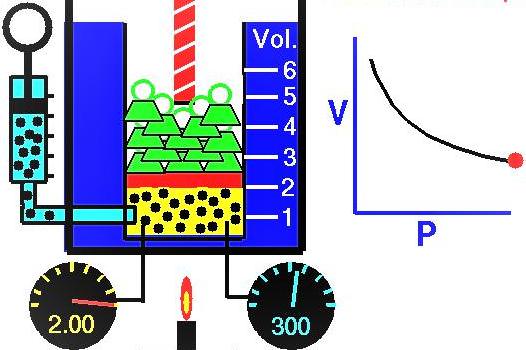
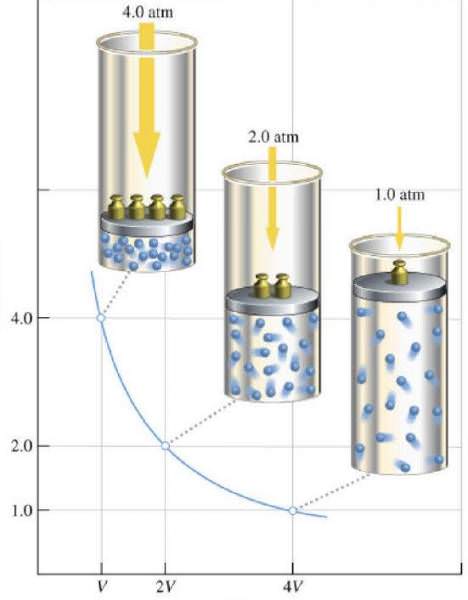
Властивості газів європейські вчені активно досліджували протягом XVII-XIX століть. Самим першим газовим законом, який був відкритий експериментально, став закон, що описує ізотермічні процеси розширення і стиснення газової системи. Відповідні досліди були проведені Робертом Бойлем в 1662 році і Эдмом Мариотто в 1676 році. Кожен з цих вчених незалежно показав, що під час ізотермічного процесу в закритій газовій системі змінюється тиск обсягом обернено пропорційно. Отримане експериментально математичне вираження процесу записується в наступному вигляді:
P*V = k
Де P і V – тиск в системі і її обсяг, k – деяка постійна, значення якої від кількості речовини газу і залежить від його температури. Якщо побудувати залежність функції P(V) на графіку, то вона буде представляти собою гіперболу. Приклад цих кривих показаний нижче.
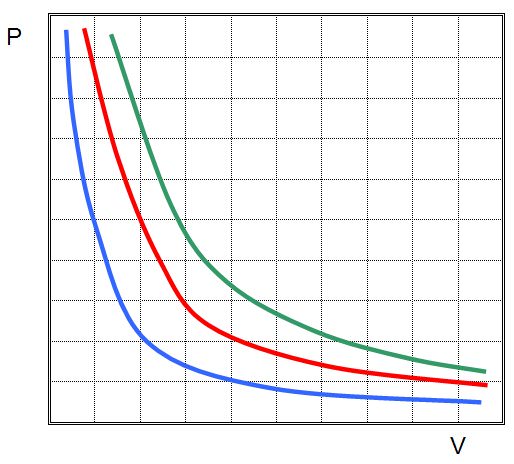
Записане рівняння називається рівнянням (законом) Бойля-Маріотта. Цей закон коротко можна сформулювати так: розширення ідеального газу при постійній температурі призводить до пропорційного зменшення тиску в ньому, навпаки, ізотермічне стиснення газової системи супроводжується пропорційним підвищенням тиску в ній.
Рівняння стану ідеального газу
Бойля-Маріотта, закон приватним випадком більш загального закону, який носить прізвища Менделєєва і Клапейрона. Еміль Клапейрон, узагальнюючи експериментальну інформацію поведінки газів при різних зовнішніх умовах, в 1834 році отримав наступне рівняння:
P*V = n*R*T
Іншими словами, твір обсягу V газової системи на тиск P в ній прямо пропорційно добутку абсолютної температури T на кількість речовини n. Коефіцієнт цієї пропорційності позначений буквою R і називається універсальної газової сталої. У записаному рівнянні величина R з’явилася завдяки заміні ряду констант, яку зробив Дмитро Іванович Менделєєв в 1874 році.
З універсального рівняння стану легко побачити, що постійність температури і кількості речовини гарантує незмінність правій частині рівності, а отже, ліва частина рівності також буде залишатися постійною. У такому разі ми отримуємо рівняння Бойля-Маріотта.
Інші газові закони
Записане в пункті вище Клапейрона-Менделєєва рівняння містить три термодинамічних параметрів: P, V і T. Якщо кожен з них фіксувати, а двом іншим дозволяти змінюватися, то ми отримаємо рівняння Бойля-Маріотта, Шарля і Гей-Люссака. Шарля закон говорить про прямий пропорційності між об’ємом і температурою для изобарного процесу, а Гей-Люссака, закон стверджує, що в разі ізохорний переходу тиск газу зростає або зменшується абсолютній температурі прямо пропорційно. Відповідні рівняння виглядають так:
V/T = const при P = const;
P/T = const при V = const.
Таким чином, Бойля-Маріотта, закон є одним з трьох основних газових законів. Тим не менш він відрізняється від інших в плані графічної залежності: функції V(T) і P(T) є прямими лініями, функція P(V) – це гіпербола.
Приклад задачі на застосування Бойля-Маріотта закону
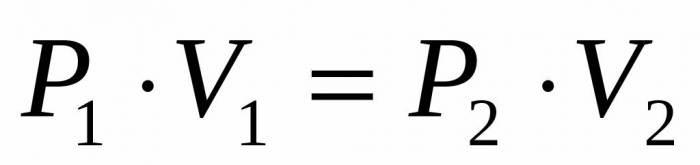
Обсяг газу в циліндрі під поршнем в початковому положенні становив 2 літри, і його тиск було одно 1 атмосфера. Чому стало одно тиск газу після того, як поршень піднявся, і обсяг газової системи збільшився на 0,5 літра. Процес вважати ізотермічним.
Оскільки нам дано тиск і об’єм ідеального газу, а також відомо, що температура в процесі його розширення залишається незмінною, то ми вправі скористатися рівнянням Бойля-Маріотта у наступній формі:
P1*V1 = P2*V2
Це рівність говорить про те, що твір на обсяг тиску є постійним для кожного стану газу при даній температурі. Висловлюючи рівності величину P2, отримуємо кінцеву формулу:
P2 = P1*V1/V2
При виконанні обчислень тиску можна використовувати позасистемні одиниці в даному випадку, оскільки літри скоротяться, і ми отримаємо тиск P2 в атмосферах. Підставивши дані з умови, приходимо до відповіді на питання завдання: P2 = 0,8 атмосфери.