Основні характеристики
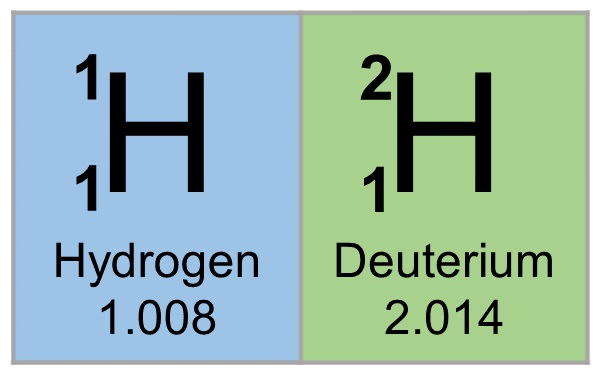
Ізотопна маса дейтерію – 2,014102 од. Дейтерій має стабільний період напіврозпаду, оскільки він є стабільним ізотопом.
Надлишкова енергія дейтерію становить 13 135,720 ± 0,001 кев. Енергія зв’язування для ядра дейтерію – 2224,52 ± 0,20 кев. Дейтерій з’єднується з киснем з утворенням D2O (2Н2О), так само відомому, як важка вода. Дейтерій – це не радіоактивний ізотоп.
Дейтерій не небезпечний для здоров’я, але може бути використаний для створення ядерної зброї. Дейтерій не проводиться штучно, оскільки він природним чином у великій кількості присутній в океанській воді і може служити багатьом поколінням людей. Його витягують з океану, використовуючи процес центрифугування.
Важкий водень
Важкий водень – це назва будь-якого з вищих ізотопів водню, таких як дейтерій і тритій. Але найчастіше воно використовується для дейтерію. Його атомна маса становить близько 2, і в його ядрі міститься 1 протон і 1 нейтрон. Таким чином, його маса в два рази більше маси нормального водню. Додатковий нейтрон в дейтерію робить його важче нормального водню, тому його називають важким воднем.
Важкий водень був виявлений Гарольдом Юрі в 1931 році – це відкриття було удостоєно Нобелівської премії по хімії в 1934 році. Юрі передбачив різницю між тиском пари молекулярного водню (H2) і відповідної молекули з одним атомом водню, заміненим дейтерієм (HD), і, таким чином, можливість поділу цих речовин шляхом перегонки рідкого водню. Дейтерій був виявлений в залишок від перегонки рідкого водню. Він був приготований в чистому вигляді Р. Н. Льюїсом з допомогою електролітичного методу концентрації. Коли вода електризується, утворюється газоподібний водень, який містить невелику кількість дейтерію, тому дейтерій концентрується у воді. Коли кількість води зменшується до приблизно ста тисячних від її початкового об’єму в результаті триваючого електролізу, забезпечується майже чистий оксид дейтерію, відомий як важка вода. Цей метод приготування важкої води був використаний під час Другої світової війни.