Незважаючи на те, що алкани малоактивні, вони здатні на виділення великої кількості енергії при взаємодії з галогенами або іншими вільними радикалами. Алкани та реакції з ними постійно використовують у багатьох сферах промисловості.
Факти про алканах
В органічній хімії алкани займають важливе місце. Формула алканів в хімії – c n h 2n+2. На відміну від ароматичних речовин, у яких є бензольное кільце, алкани вважаються аліфатичними (ациклічні).
В молекулі будь-якого алкана всі елементи з’єднані одинарним зв’язком. Тому у даної групи речовин закінчення «-ан». Відповідно, у алкенів є одна подвійна зв’язок, а у алкіной – одна потрійна. У алкодиенов, наприклад, дві подвійні зв’язки.
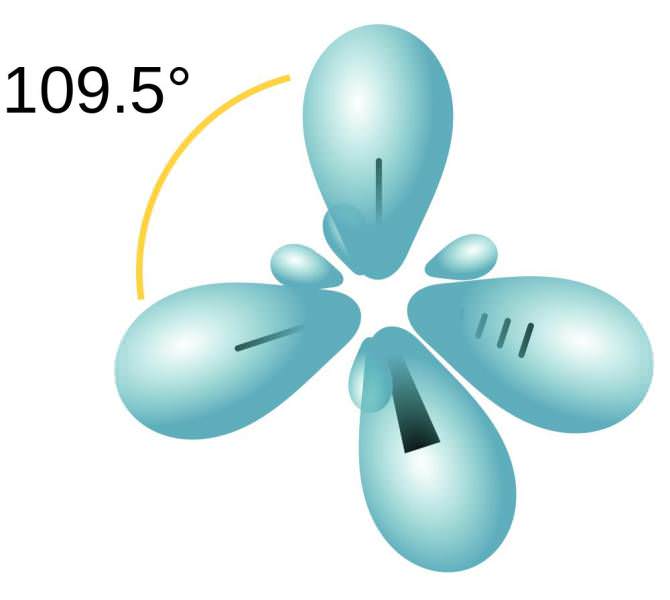
Алкани – насичені вуглеводні. Тобто в них знаходиться максимальна кількість атомів Н (водню). Всі атоми вуглецю в алкане перебувають у стані sp3 – гібридизації. Це означає, що молекула алкана будується за правилом тетраедра. Молекула метану (СН4) нагадує тетраедр, а решта алкани мають зигзагоподібну структуру.
Всі атоми З в алканах з’єднані з допомогою ơ – зв’язку (сигма). Зв’язку С―С є неполярними, зв’язку С―Н – слабополярними.
Властивості алканів
Як вже говорилося вище, група алканів володіє малою активністю. Зв’язку між двома атомами С і між атомами С і Н міцні, тому їх складно зруйнувати впливом ззовні. Всі зв’язки в алканах є ơ – зв’язками, тому, якщо вони розриваються, це зазвичай призводить до появи радикалів.
Галогенирование алканів
Зважаючи особливих властивостей зв’язків атомів, алканів притаманні реакції заміщення і розкладання. В реакціях заміщення у алканів атоми водню змінюють інші атоми або молекули. Алкани добре реагують з галогенами – речовинами, що знаходяться в 17 групі періодичної таблиці Менделєєва. Є галогенами фтор (F), бром (Br), хлор (Cl), йод (I), астат (At) і теннессин (Ts). Галогени дуже сильні окислювачі. Вони реагують практично з усіма речовинами з таблиці Менделєєва Д. І..
Реакції хлорування алканів
На практиці участь в галогенировании алканів приймають зазвичай бром і хлор. Фтор дуже активний елемент – з ним реакція буде вибуховою. Йод – слабкий, тому реакція заміщення з ним йти не буде. А астата дуже мало в природі, тому складно зібрати достатню його кількість для проведення експериментів.
Стадії галогенирования
Всі алкани проходять три стадії галогенирования:

Бромирование алканів
При галогенировании вищих алканів, що йдуть після етану, складність представляє утворення ізомерів. З одного речовини під дією сонячного світла можуть утворитися різні ізомери. Відбувається це в результаті реакції заміщення. Це доказ того, що при галогенировании вільним радикалом може бути заміщений будь атом Н у алкане. Складний алкан розпадається на дві речовини, процентний вміст яких може сильно варіюватися в залежності від умов реакції.

Бромирование пропану (2-бромпропан). При реакції галогенирования пропану молекулою Br2 під впливом високих температур і сонячного світла виходять 1-бромпропан – 3 % і 2-бромпропан – 97 %.
Бромирование бутану. При бромировании бутану під дією освітлення і високих температур виходить 2 % 1-бромбутана і 98 % 2-бромбутана.
Відмінність хлорування та бромування алканів
Хлорування частіше використовують у промисловості. Наприклад, для виробництва розчинників, у яких міститься суміш ізомерів. При отриманні галогеналканы складно відокремлювати один від одного, але зате на ринку суміш коштує дешевше, ніж чистий продукт. В лабораторіях більше поширене бромирование. Бром слабкіше хлору. У нього низька реакційна здатність, тому у атомів брому висока селективність. Це означає, що під час реакції атоми «обирають», який атом водню їм замінити.
Характер реакції хлорування
При хлоруванні алканів ізомери утворюються приблизно у рівній кількості у своїй масовій частці. Наприклад, хлорування пропану при каталізаторі у вигляді підвищення температури до 454 градусів видає нам 2–хлорпропан і 1-хлорпропан в співвідношенні 25 % і 75 % відповідно. Якщо реакція галогенирования проходить тільки за допомогою ультрафіолетового випромінювання, 1–хлорпропана виходить 43 %, а 2-хлорпропана – 57%. В залежності від умов проведення реакції співвідношення отриманих ізомерів може змінюватися.
Характер реакції бромування
В результаті реакцій бромування алканів легко виходить майже чиста речовина. Наприклад, 1-бромпропан – 3 %, 2-бромпропан – 97% з молекули н-пропану. Тому бромирование часто застосовують у лабораторіях для синтезу певної речовини.
Сульфування алканів
Алкани сульфируются також за механізмом радикального заміщення. Щоб сталася реакція, на алкан одночасно впливають кисень і оксид сірки SO2 (сірчистий ангідрид). У результаті реакції алкан перетворюється в алкилсульфокислоту. Приклад сульфування бутану:
СН3СН2СН2СН3 + О2 + SO2 → CH3CH2CH2CH2SO2OH
Загальна формула сульфоокисления алканів:
R―H + О2 + SO2 → R―SO2OH

Сульфохлорирование алканів
У разі сульфохлорирования замість кисню в якості окислювача використовується хлор. Таким способом отримують алкансульфохлориды. Реакція сульфохлорирования звична для всіх вуглеводнів. Вона відбувається при кімнатній температурі і сонячному освітленні. Також в якості каталізатора застосовують органічні пероксиди. Така реакція зачіпає тільки вторинні і первинні зв’язку, що відносяться до атомів вуглецю і водню. До третинних атомів справа не доходить, так як відбувається обрив ланцюга реакції.
Реакція Коновалова
Реакція нітрування, як і реакція галогенирования алканів, проходить по вільно-радикальному механізму. Проводять реакцію, використовуючи сильно розбавлену (10 – 20 %) азотну кислоту (HNO3). Механізм реакції: в результаті реакції алкани утворюють суміш сполук. Для каталізації реакції використовують підвищення температури до 140⁰ і нормальний або підвищений тиск навколишнього середовища. При нитровании руйнуються зв’язку С―С, а не тільки З―Н на відміну від попередніх реакцій заміщення. Це означає, що відбувається крекінг. Тобто реакція розщеплення.
Реакції окислення і горіння
За вільнорадикального типу проходять реакції окиснення алканів. Для парафінів існує три види переробки з допомогою окисної реакції.
В процесі окислення вільний радикал О2 повністю або частково заміщає водневу складову. Повне окислення – це горіння.

Добре алкани згоряють використовуються як паливо для теплоелектростанцій і двигунів внутрішнього згоряння. Гарячі алкани виробляють дуже багато теплової енергії. В двигуни внутрішнього згоряння поміщають складні алкани. Взаємодія з киснем у простих алканів може призвести до вибуху. З продуктів відходу, що утворюються в результаті реакцій з алканами, роблять асфальт, парафін і різні мастила для промисловості.