Закон Клапейрона-Менделєєва
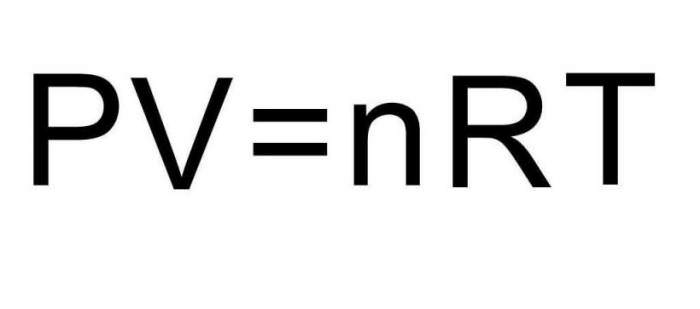
Переходами між різними агрегатними станами речовини і процесами в рамках одного агрегатного стану займається термодинаміка. Тиск, температура і об’єм є трьома величинами, які однозначно визначають будь-який стан термодинамічної системи. Формула рівняння стану ідеального газу об’єднує в єдине рівність всі три зазначені величини. Запишемо цю формулу:
P*V = n*R*T
Тут P, V, T – тиск, об’єм, температура, відповідно. Величина n – це кількість речовини в молях, а символом R позначена універсальна постійна газів. Ця рівність показує, що чим більше добуток тиску на об’єм, тим більше повинно бути добуток кількості речовини на температуру.

Формула рівняння стану газу називається законом Клапейрона-Менделєєва. У 1834 році французький вчений Еміль Клапейрон, узагальнивши експериментальні результати його попередників, прийшов до цього рівняння. Однак Клапейрона користувався поруч констант, які Менделєєв згодом замінив одного – універсальної газової сталої R (8,314 Дж/(моль*К)). Тому в сучасній фізиці це рівняння названо за прізвищем французького і російського вчених.