Принцип Авогадро і газові суміші
Крім викладених вище газових законів, рівняння стану ідеального газу також призводить до відкритого Амедео Авогадро на початку XIX століття принципом, який носить його прізвище. Цей принцип встановлює, що обсяг будь-якого газу при постійних тиску і температурі визначається кількістю речовини в системі. Відповідна формула виглядає так:
n/V = const при P, T = const.
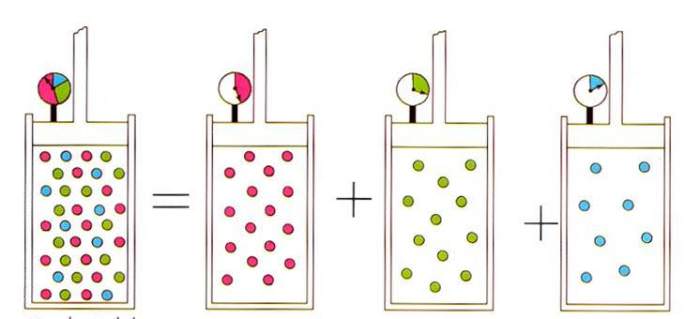
Записане вираз призводить до відомого у фізиці ідеальних газів законом Дальтона для газових сумішей. Цей закон говорить, що парціальний тиск газу в суміші однозначно визначається його атомної часток.
Приклад розв’язання задачі
В закритій посудині з жорсткими стінками, що містить ідеальний газ, в результаті нагрівання тиск збільшився в 3 рази. Необхідно визначити кінцеву температуру системи, якщо її початкове значення дорівнювало 25 oC.
Спочатку переведемо температуру з градусів Цельсія Кельвины, маємо:
T = 25 + 273,15 = 298,15 К.
Оскільки стінки судини є жорсткими, то процес нагрівання можна вважати изохорным. Для цього випадку застосуємо закон Гей-Люссака, маємо:
P1/T1 = P2/T2 =>
T2 = P2/P1*T1.
Таким чином, кінцева температура визначається з добутку відношення тисків і початкової температури. Підставляючи в рівність дані, отримуємо відповідь: T2 = 894,45 К. Ця температура відповідає 621,3 oC.