Інші форми запису рівняння
Вище ми записали рівняння стану ідеального газу Менделєєва-Клапейрона в загальноприйнятому та зручному вигляді. Однак у завданнях з термодинаміки часто може знадобитися трохи інший вигляд. Нижче записані ще три формули, які безпосередньо випливають із записаного рівняння:
P*V = N*kB*T;
P*V = m/M*R*T;
P = ρ*R*T/M.
Ці три рівняння також є універсальними для ідеального газу, тільки в них з’являються такі величини, як маса m, молярна маса M, щільність ρ і число частинок N, що складає систему. Символом kB тут позначено постійна Больцмана (1,38*10-23 Дж/К).
Закон Бойля-Маріотта
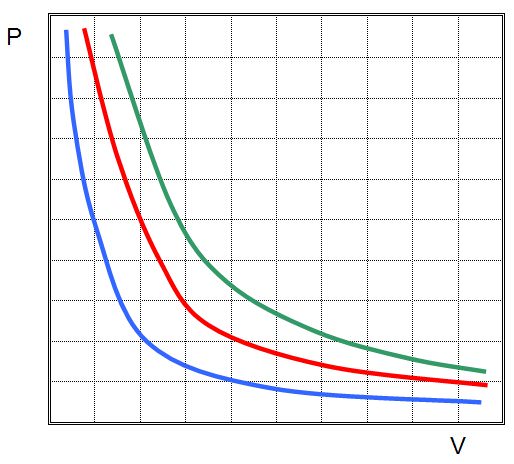
Коли Клапейрона становив своє рівняння, то він ґрунтувався на газових законах, які були відкриті експериментально кілька десятиліть раніше. Одним із них є закон Бойля-Маріотта. Він відображає ізотермічний процес в закритій системі, в результаті якого змінюються такі макроскопічні параметри, як тиск і об’єм. Якщо покласти T і n постійними в рівнянні стану ідеального газу, газовий закон тоді прийме вигляд:
P1*V1 = P2*V2
Це і є закон Бойля-Маріотта, який говорить про те, що твір тиск на обсяг зберігається під час довільного ізотермічного процесу. При цьому самі величини P та V змінюються.
Якщо зображати графік залежності P(V) або V(P), то ізотерми будуть представляти собою гіперболи.