Загальна характеристика неметалів
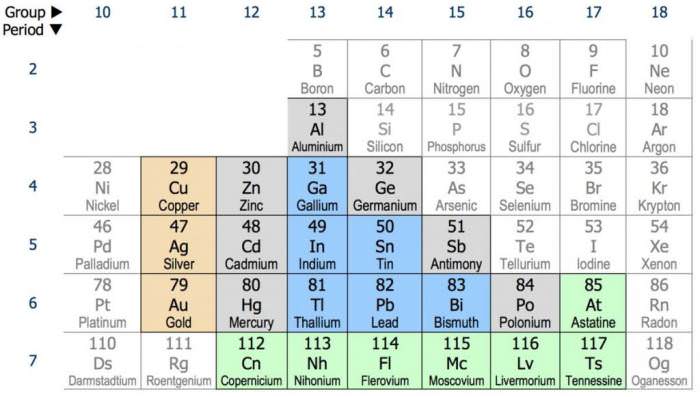
Атоми неметалічних елементів містять на зовнішньому рівні від чотирьох до семи електронів і по вісім електронів у інертних газів, за винятком водню (один електрон) і гелію (2 електрона). Тому в загальній характеристиці будови атомів неметалів – це здатність приймати і віддавати електрони, граючи роль як окислювачів, так і відновників.
Таким чином, у з’єднаннях неметалічні елементи проявляють як негативні, так і позитивні ступені окиснення. Характерні значення валентності та ступеня окиснення неметалів пов’язані з будовою їхнього зовнішнього електронного рівня
Так, наприклад, сірка може виявляти валентність 2, 4, 6 за рахунок роз’єднання електронів. У природі неметали, крім кисню, азоту, водню, сірки та інертних газів, існують у вигляді сполук: сульфідів, оксидів, хлоридів, силікатів, сульфатів, карбонатів, фосфатів різних металів.
Неметалічні елементи у вільному вигляді існують у вигляді простих речовин неметалів. Розглянемо їх будова, властивості та застосування. Атоми неметалів пов’язані між собою ковалентним зв’язком. Форми існування неметалів різні. Водень, йод, хлор, фтор, бром, існують тільки у вигляді двоатомних молекул H2, I2, Cl2, F2 Br2. Причина полягає в тому, що у них є тільки одна можливість утворити загальну пару за рахунок єдиного локалізації неспареного електрона.