Розглянемо основні хімічні формули речовин. Прийнято виділяти суміші і чисті речовини. Якщо перші передбачають наявність кількох компонентів, кожен з яких зберігає індивідуальні властивості, то чисті речовини не передбачають присутності будь-яких домішок. Проаналізуємо основні хімічні формули для розв’язання задач, що пропонуються випускникам основної та середньої школи.

Класифікація
Почнемо з того, що існує підрозділ сполук на прості і складні речовини. Основні хімічні реакції, що розглядаються в курсі хімії 8-9 класу, стосуються води, кисню, водню. Зупинимося на них докладніше.
Вода
Розглядаючи основні хімічні формули, не можна залишити без уваги той з’єднання, без якого неможливе існування людини. Н2О – цю формулу знають не тільки старшокласники, але й діти з початкової школи. У складі молекули два атоми водню і один атом кисню, сполучені між собою ковалентного полярного хімічної зв’язком.
Вода необхідна для протікання обмінних процесів, вона є активною сполукою, взаємодіючим з простими і складними органічними і неорганічними речовинами.

Кисень
Вивчаючи основні хімічні формули в рамках шкільної програми, обов’язковим є розгляд О2. Це просте речовина з ковалентного неполярного зв’язком, утворене двома атомами водню, необхідно живим істотам для дихання. Молекулярний кисень бере активну участь і в реакціях горіння, утворюючи з білками, жирами, вуглеводами кілька продуктів: оксид вуглецю (4) і воду.
Основні хімічні реакції при горінні граничних і неграничних вуглеводнів є базою для залишення розрахункових завдань. Наведемо один з прикладів з курсу 10 класу органічної хімії. Припустимо, необхідно визначити обсяг газу, який потрібен для повного згоряння 30 літрів газоподібного метану. Для того щоб впоратися з поставленим завданням, спочатку записується рівняння протікає взаємодії, розставляються коефіцієнти:
СН4+ОБСЯЗІ 2О2=СО2+2Н2О
Далі складається пропорція з урахуванням того, що за законом Авогадро молярний відносини будуть рівні об’ємним. Далі проводяться математичні розрахунки.

Срібло
Аналізуючи прості речовини, необхідно детальніше зупинитися на деяких з них. Зокрема, інтерес представляє такий метал срібло. Здавна він приваблював людей своїм блиском, незначною реакційною здатністю. Протягом декількох століть саме срібло застосовувалося для знезараження питної води. Даний метод ліг в основу створення сучасних побутових фільтрів, призначених для видалення мікроорганізмів з питної води. У природі він знаходиться у вигляді самородків. Так, є згадки про те, що в XV столітті на руднику «Святий Георгій» самородок був знайдений срібла, вага якого становив 20 тонн.
У природі є срібні руди (в яких близько 50% самого металу), а також поліметалічні комплексні сполуки (в них срібла не більше 15%). Подібні руди є в Японії, Болівії, США, Перу, Австралії, Канаді.
Це пластичний метал сріблястого білого кольору (з високою електричною провідністю) має бактерицидні властивості. У нашій країні ГДК срібла у питній воді встановлений нормами Санітарно-гігієнічного контролю, він становить 0,05 мг/л. В середні століття даного металу надавали магічні властивості: захист від злих сил, вампірів, демонів. Якщо на людині срібні вироби темніли, вважалося, що він невиліковно хворий. Цей метал використовують в електроніці, ювелірній справі, фотографії, електротехніці, медицині.

Сірчана кислота
Розглядаючи основні хімічні формули неорганічних речовин, які повинні знати школярі, не можна залишити без уваги цю кислородсодержащую кислоту. Вихідною сировиною для її виробництва є пірит (FeS2), сірководень (H2S), кристалічна сірка (S). В даний час в хімічній промисловості використовується ступеневу отримання даної кислоти. Спочатку окислюється до пічного газу (оксиду сірки 4) вихідна сировина, потім воно окислюється до оксиду сірки (6), потім відбувається гідратація.
У харчовій промисловості вона використовується в якості добавки Е513. Виступаючи у вигляді емульгатора, сірчана кислота застосовується у виробництві напоїв (регулює кислотність). Також Е513 є складовим компонентом мінеральних добрив. В органічному синтезі сірчана кислота виступає каталізатором різних реакцій: гідратації, дегідрування, алкілування.
В домашніх умовах H2SO4 виступає електролітом для автомобільних акумуляторів. При роботі з нею важливо дотримуватися правила обережності, так як сірчана кислота є їдким хімічною речовиною.

Сульфати
Аналізуючи основні хімічні формули неорганічних сполук, необхідно приділити окрему увагу солей сірчаної кислоти. Сульфат магнію, наприклад, має проносний ефект. Його вводять в якості спазмолитика хворих у разі гіпертонічної хвороби, а також для поліпшення відведення жовчі. Також MgSO4 має протисудомний ефект.
Тіосульфат натрію — лікарський засіб, що є протиотрутою для свинцю, ціанідів, галогенів, ртуті.
Разом з соляною кислотою тіосульфат натрію застосовується для лікування різноманітних дерматологічних хвороб. Наприклад, ці препарати затребувані для лікування корости.

Вуглеводи
В рамках шкільної програми розглядаються основні хімічні формули органічних сполук. Зупинимося лише на деяких з них. Зокрема, глюкоза має молекулярну формулу С6Н12О6. Дана речовина відноситься до класу вуглеводів (моносахарид), володіє якісними реакціями на альдегидную групу, що міститься в молекулі: «срібного дзеркала», «ігри квітів».
Цей моносахарид необхідний для клітин головного мозку, а також для еритроцитів крові. У разі малорухливого способу життя потреба у ній у людини знижується.
Органічні кислоти
Основні формули хімічних елементів, що розглядаються в курсі старшої школи, дають уявлення про багатогранність органічної хімії. Зокрема, гіалуронова кислота — це один з найважливіших будівельних матеріалів позаклітинного простору сполучних тканин – матриксу – це глікозаміноглікани, до яких відноситься гіалуронова кислота (гіалуронан). Завдяки цій речовині тканини забезпечені функцією антистиску: гіалуронан вбирає великий обсяг води, стає гелеподібні речовиною, що перешкоджає процесу набухання.
Гіалуронова кислота дозволяє поживними компонентами вільно поширюватися по всіх тканинах. Вона є в складі більшості розчинів, призначених для косметичних уколов. Дана речовина сприяє зміцненню, розгладженню шкірного покриву, запуску регенерації клітин дерми.
В косметології застосовують гіалуронові ін’єкції, живлять клітини киснем, підвищують захисні здібності шкіри, виводять токсичні речовини, що підвищують пластичність шкірного покриву, нормалізують водний баланс.
Синтетична молочна кислота
Ця речовина виділяється в м’язових тканинах під час тривалої фізичної активності. У салонах краси використовують синтетичну молочну кислоту, що мінімізує ймовірність розвитку алергії. Препарати, в яких активною речовиною є молочна кислота, сприяє наданню форми щоках, вилицях, розгладження складок поблизу носа і губ, позбавлення від зморшок.
Процедура займає не більше 30 хвилин. Проводиться очищення шкіри від забруднень, наноситься антисептик, вводяться ін’єкції, потім косметолог робить масаж оброблюваної області. Не можна обробляти синтетичної молочною кислотою область чола, губ, очей. Протипоказані такі процедури вагітним жінкам, підліткам, а також людям, які мають хвороби кровоносної системи.

Характеристика гліколевої кислоти
Гліколева кислота відноситься до розряду фруктових або альфа-гідроксильних кислот. У природі міститься у винограді, цукрових буряках, цукровому очереті. HOOC-CH2-OH — це найпростіша гидроксикислота. Безбарвні кристали з запахом паленого цукру, вони добре розчиняється введенні, спирті, діетиловому ефірі.
Косметика з гліколевої кислотою особливо часто застосовується підлітками при догляді за жирним типом шкіри, так як дає можливість позбутися від сального блиску, звузити пори і усунути акне. Чим більше активність сальних залоз, тим вище повинна бути концентрація цієї активної речовини в складі засобу. Гліколева кислота підходить для боротьби з невеликими запаленими ділянками на шкірі, ексфоліації рогового шару епідермісу, включаючи і надчутливу шкіру.
Розрахункові завдання
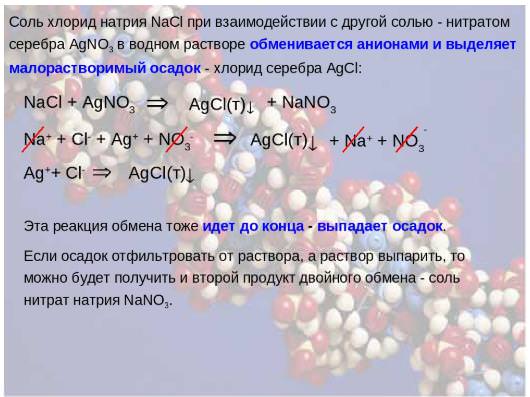
Основні хімічні формули для розв’язування задач з хімії, які пропонуються дев’ятикласникам на підсумковому іспиті з хімії, пов’язані з різними типами хімічних реакцій. Наведемо конкретний приклад. Необхідно визначити масу осаду, що утворюється при взаємодії 100 г розчину з масовою часткою 10% з надлишком кухонної солі.
Для того щоб впоратися з подібним завданням, спочатку потрібно визначити масу речовини через пропорцію. Далі складається рівняння реакції взаємодії між хлоридом натрію і нітратом срібла. Користуючись періодичною системою хімічних елементів Менделєєва Д. І., визначаються молярні маси речовин, потім їх маси з урахуванням коефіцієнтів. Останньою дією є рішення пропорції, визначення маси осаду, в якості якого виступає хлорид срібла.
Важливі моменти
Основні хімічні формули речовин та їх назви — це питання, які включені до завдання ОГЕ і ЄДІ. Хлопці повинні володіти термінологією, вміти виділяти прості і складні сполуки, визначати належність сполук до одного з класів неорганічних (органічних) речовин.
Підіб’ємо підсумки
В даний час існує безліч речовин, які розглядаються в рамках шкільного курсу хімії. Приміром, у 8-9 класах особлива увага приділяється розгляду наступних класів неорганічних речовин: кислот, основ, оксидів, солей. У старшій школі в рамках органічної хімії аналізуються спирти, карбонові кислоти, альдегіди, вуглеводи, жири, різні класи вуглеводнів.
Типові представники кожного класу органічних і неорганічних сполук зустрічаються також і в розрахункових задачах, типи яких вивчаються не тільки на уроках хімії, але і в рамках факультативних занять (у позаурочний час).