Газове стан навколишнього нас матерії являє собою одну з трьох поширених форм речовини. Зазначене текуче агрегатний стан у фізиці прийнято розглядати в наближенні ідеального газу. Використовуючи це наближення, опишемо в статті можливі изопроцессы в газах.
Ідеальний газ і універсальне рівняння для його опису
Ідеальним називають такий газ, частинки якого не мають розмірів і не взаємодіють один з одним. Очевидно, що не існує жодного газу, який би задовольняв цим умовам, оскільки навіть самий маленький атом – водень, володіє певними розмірами. Більш того, навіть між нейтральними атомами благородних газів існує слабке ван-дер-ваальсовое взаємодія. Тоді постає питання: в яких випадках можна знехтувати розмірами газових частинок і взаємодією між ними? Відповіддю на це питання буде дотримання таких фізико-хімічних умов:
- низький тиск (порядку 1 атмосфери і нижче);
- високі температури (близько кімнатній і вище);
- хімічна інертність молекул і атомів газу.
Якщо хоча б одна з умов не дотримується, то газ слід вважати реальним і описувати його спеціальним рівнянням Ван-дер-Ваальса.
Рівняння Менделєєва-Клапейрона необхідно розглянути перед вивченням изопроцессов. Рівняння ідеального газу – його друга назва. Воно має наступну форму запису:
P*V = n*R*T
Тобто воно пов’язує три термодинамічні параметри: тиск P, температури T і об’єм V, а також кількість n речовини. Символом R тут позначено газова постійна величина, вона дорівнює 8,314 Дж / (К * моль).
Що таке изопроцессы в газах?
Під цими процесами розуміють переходи між двома різними станами газу (початковим і кінцевим), в результаті яких зберігаються одні величини і змінюються інші. Виділяють три типи ізопроцесів в газах:
- ізотермічний;
- ізобарний;
- ізохорний.

Важливо відзначити, що всі вони були експериментально вивчені і описані в період з другої половини XVII ст. і до 30-х років XIX століття. На підставі цих експериментальних результатів Еміль Клапейрон в 1834 році отримав рівняння, універсальне для газів. Дана ж стаття побудована навпаки – застосовуючи рівняння стану, отримаємо формули для изопроцессов в ідеальних газах.
Перехід при постійній температурі
Він називається ізотермічним процесом. З рівняння стану ідеального газу випливає, що при постійній абсолютній температурі в закритій системі повинно залишатися постійним добуток об’єму на тиск, тобто:
P*V = const
Цю залежність дійсно спостерігали Роберт Бойль і Эдм Маріотт у другій половині XVII століття, тому в даний час записане рівність носить їх прізвища.
Функціональні залежності P(V) або V(P), виражені графічно, мають вигляд гіпербол. Чим вище температура, при якій проводять ізотермічний експеримент, тим більше добуток P*V.
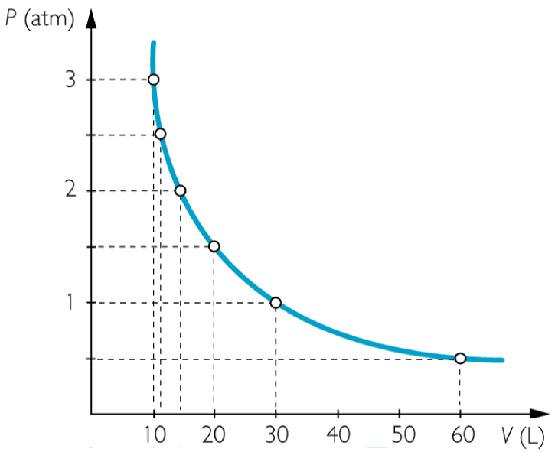
При ізотермічному процесі газ розширюється або стискається, здійснюючи роботу і не змінюючи своєї внутрішньої енергії.
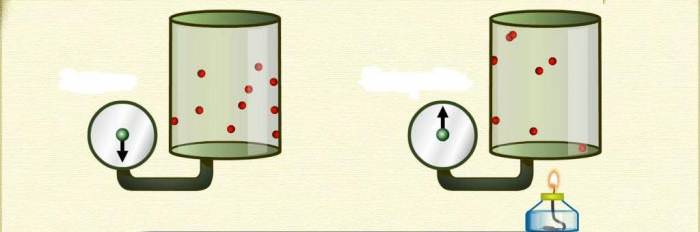
Перехід при постійному тиску
Тепер вивчимо ізобарний процес, під час якого тиск підтримується постійним. Прикладом такого переходу є нагрівання газу, що знаходиться під поршнем. В результаті нагріву збільшується кінетична енергія частинок, вони починають частіше і з більшою силою ударяти по поршню, в результаті чого газ розширюється. У процесі розширення газ виконує певну роботу, ККД якої становить 40 % (для одноатомного газу).
Для цього ізопроцесів рівняння стану ідеального газу говорить про те, що повинно виконуватися наступне співвідношення:
V/T = const
Отримати його легко, якщо постійний тиск перенести в праву частину рівняння Клапейрона, а температуру – в ліву. Ця рівність називається законом Шарля.
Рівність свідчить про те, що функції V(T) і T(V) мають вигляд прямих ліній на графіках. Нахил лінії V(T) відносно осі абсцис буде тим менше, чим більше величина тиску P.
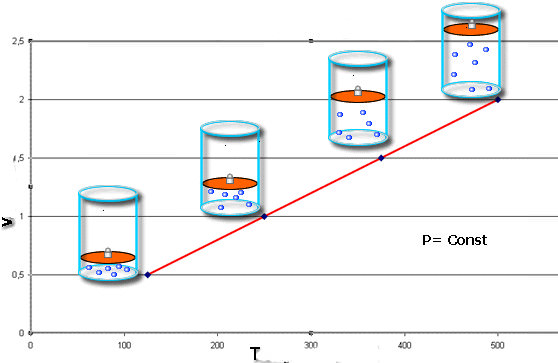
Перехід при незмінному обсязі
Останнім изопроцессом в газах, який ми розглянемо у статті, є ізохорний перехід. Використовуючи універсальне рівняння Клапейрона, нескладно отримати наступне рівняння для цього переходу:
P/T = const
Ізохорний перехід описується законом Гей – Люссака. Видно, що графічно функції P(T) і T(P) будуть представляти собою прямі лінії. Серед усіх трьох изопроцессов, ізохорний є найефективнішим, якщо необхідно підвищити температуру системи за рахунок підведення зовнішнього тепла. Під час цього процесу газ не здійснює роботи, тобто все тепло буде спрямовано на збільшення внутрішньої енергії системи.