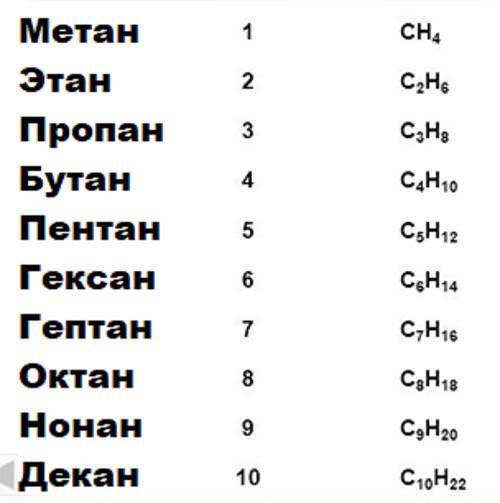
Хімічні властивості
Ми вже говорили про те, що вуглець з потрійним зв’язком у ацетилені набагато більш электроотрицателен, ніж, наприклад, вуглець зі зв’язком подвійний (як у этилене) або одинарної (етан). Здатність ацетилену реагувати з деякими металами, віддаючи іон водню і заміщаючи його іоном металу (наприклад, реакція утворення ацетиленида натрію при взаємодії ацетилену з металевим натрієм) підтверджує це. Ми називаємо цю здатність ацетилену одним з кислотних властивостей відповідно до теорії Бренстеда – Лоурі: згідно з нею, кислотність речовини визначається його здатністю відщепнути від себе протон. Кислотність ацетилену (в ацетилениде міді також) можна розглянути щодо аміаку і води: при взаємодії аміда металу з ацетиленом утворюється ацетиленид і аміак. Тобто ацетилен віддає протон, що характеризує його як більш сильну, ніж аміак, кислоту. У випадку з водою ацетиленид міді розкладається, утворюючи ацетилен – він приймає протон води, показуючи себе менш сильною кислотою, ніж вода. Так, у відносному ряді кислотності (за Бренстеду – Лоурі) ацетилен є слабкою кислотою, перебуваючи десь між водою і аміаком.
Ацетиленид міді(I) нестійкий: у воді (як нам вже відомо) і в розчинах кислот він розкладається з виділенням газу ацетилену і червоно-коричневого осаду – оксиду міді(I) або білого осаду хлориду міді(I) у випадку розведення розчином соляної кислоти.
Щоб уникнути вибуху, розкладання ацетиленида проводять обережним нагріванням у вологому вигляді в присутності сильної мінеральної кислоти, наприклад розведеної азотної.