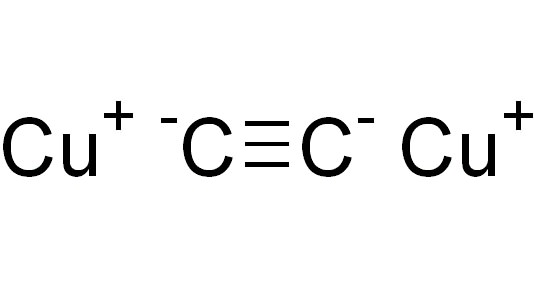Ацетиленид міді є металлорганическим бінарним з’єднанням. Ця формула відома науці принаймні з 1856 року. У кристалах утворює моногідрат з формулою Cu2C2×H2O. Термічно нестійкий, при нагріванні вибухає.
Будова
Ацетиленид міді є бінарним з’єднанням. Можна умовно виділити в ньому негативно заряджену частину – аніон C2−2, і позитивно заряджену – катіони міді Cu+. Насправді такий поділ умовно: в з’єднанні є лише частка іонного зв’язку, хоча вона більше порівняно зі зв’язком H-C≡. Але і зазначена зв’язок має дуже сильну полярність (як для ковалентного) з-за того, що атом вуглецю з потрійним зв’язком знаходиться в sp-гібридизації – його відносна электроотрицательность більше, ніж у гибридизациях sp3 (одинарна зв’язок) або sp2 (подвійний зв’язок). Саме це дозволяє вуглецю в ацетилені порівняно легко відщеплює від себе атом водню і заміщати його атомом металу, тобто проявляти властивості, притаманні кислот.