Ідеальний газ є вдалою моделлю фізики, яка дозволяє вивчати поведінку реальних газів при різних умовах. В даній статті розглянемо докладніше, що таке газ ідеальний, формулою якої описується його стан, а також розраховується як його енергія.
Концепція ідеального газу
Йдеться про газ, який утворений частинками, які не мають розміру, і невзаимодействующими один з одним. Природно, що ні одна газова система не задовольняє абсолютно точно зазначеним умовам. Тим не менше багато реальні текучі субстанції наближаються до цих умов з точністю, достатньою для вирішення багатьох практичних проблем.
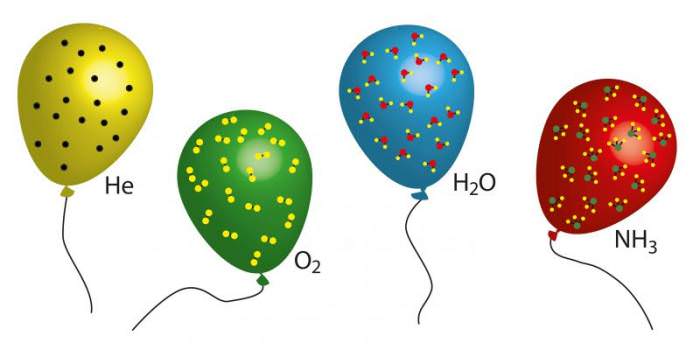
Якщо у газовій системі відстань між частинками набагато більше, ніж їх розміри, а потенційна енергія взаємодії набагато менше кінетичної енергії поступального і коливального рухів, то такий газ справедливо вважати ідеальним. Наприклад, таким є повітря, метан, благородні гази при невисоких тисках і великих температурах. З іншого боку, водяна пара навіть при низьких тисках не задовольняє концепції ідеального газу, оскільки на його поведінку молекул великий вплив мають водневі міжмолекулярні взаємодії.
Рівняння стану ідеального газу (формула)
Поведінка газів людство з використанням наукового підходу вивчає вже протягом кількох століть. Першим проривом у цій області став закон Бойля-Маріотта, отриманий експериментально в кінці XVII століття. Через століття були відкриті ще два закони: Шарля і Гей-Люссака. Нарешті, на початку XIX століття Амедео Авогадро, вивчаючи різні чисті гази, сформулював принцип, який тепер носить його прізвище.

Всі перераховані вище досягнення вчених привели Еміля Клапейрона в 1834 році до написання рівняння стану ідеального газу. Наведемо це рівняння:
P × V = n × R × T.
Важливість записаного рівності полягає в наступному:
- воно справедливо для будь-яких ідеальних газів незалежно від їх хімічного складу.
- воно пов’язує три основних термодинамічних характеристики: температуру T, об’єм V і тиск P.

Всі названі вище газові закони легко отримати з рівняння стану. Наприклад, закон Шарля автоматично випливає із закону Клапейрона, якщо покласти величину P постійної (ізобарний процес).
Універсальний закон також дозволяє отримати формулу для будь-якого термодинамічного параметра системи. Наприклад, формула об’єму ідеального газу запишеться у вигляді:
V = n × R × T / P.
Молекулярно-кінетичної теорії (МКТ)
Хоча універсальний газовий закон був отриманий чисто експериментальним шляхом, в даний час існують декілька теоретичних підходів, що приводять до рівняння Клапейрона. Один з них полягає у використанні постулатів МКТ. Згідно з ними, кожна частка газу рухається по прямій траєкторії до тих пір, поки не зустріне стінку посудини. Після абсолютно пружного зіткнення з нею, вона рухається вже по іншій прямій траєкторії, зберігаючи кінетичну енергію, яку мала до зіткнення.
Всі частинки газу мають швидкості згідно зі статистикою Максвелла-Больцмана. Важливою мікроскопічної характеристикою системи є середня швидкість, яка зберігається постійною у часі. Завдяки цьому факту вдається розрахувати температуру системи. Відповідна формула ідеального газу має вигляд:
m × v2 / 2 = 3 / 2 × kB × T.
Де m – маса частинки, kB – константа Больцмана.
З МКТ для ідеального газу випливає формула для абсолютного тиску. Вона має вигляд:
P = N × m × v2 / (3 × V).
Де N – число частинок в системі. З урахуванням попереднього виразу, нескладно перевести формулу для абсолютного тиску в універсальне рівняння Клапейрона.
Внутрішня енергія системи
Згідно з визначенням, ідеальний газ має тільки кінетичної енергією. Вона ж є його енергією внутрішньої U. Для ідеального газу формулу енергії U можна отримати, якщо помножити обидві частини рівності для кінетичної енергії однієї частинки на їх число N у системі, тобто:
N × m × v2 / 2 = 3 / 2 × kB × T × N.
Тоді отримуємо:
U = 3 / 2 × kB × T × N = 3 / 2 × n × R × T.
Ми отримали логічний висновок: внутрішня енергія прямо пропорційна абсолютній температурі в системі. Насправді отриманий вираз для U справедливо тільки для моноатомного газу, оскільки його атоми мають лише трьома поступальними ступенями свободи (тривимірне простір). Якщо ж газ є двохатомних, тоді формула для U прийме вигляд:
U2 = 5 / 2 × n × R × T.
Якщо система складається з багатоатомних молекул, тоді справедливо таке вираз:
Un>2 = 3 × n × R × T.
В останніх двох формулах також враховуються обертальні ступені свободи.
Приклад завдання
Два міль гелію знаходяться в посудині об’ємом 5 літрів при температурі 20 oC. Необхідно визначити тиск і внутрішню енергію газу.

Першим ділом переведемо всі відомі величини в СІ:
n = 2 моль;
V = 0,005 м3;
T = 293,15 К.
Тиск гелію розраховується по формулі закону Клапейрона:
P = n × R × T/V = 2 × 8,314 × 293,15 / 0,005 = 974 899,64 Па.
Розраховане тиск дорівнює 9,6 атмосферам. Так як гелій – газ благородний і одноатомний, то при такому тиску його можна вважати ідеальним.
Для одноатомного ідеального газу формула для U має вигляд:
U = 3 / 2 × n × R × T.
Підставляючи в неї значення температури і кількості речовини, отримуємо енергію гелію: U = 7311,7 Дж.