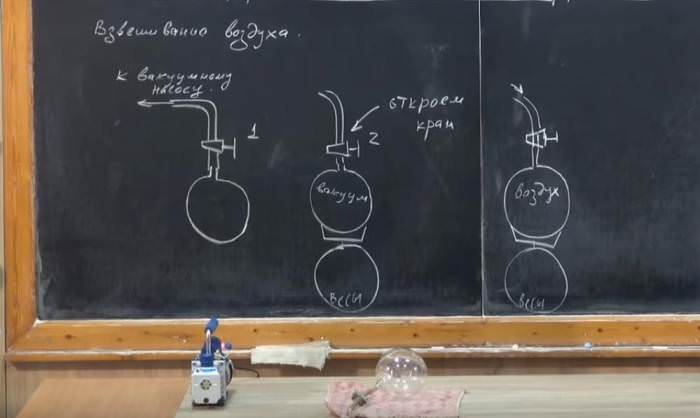
Приклад завдання
Необхідно розрахувати молярную концентрацію молекул кисню в повітрі при нормальних умовах.

Для вирішення цієї задачі згадаймо, що в повітрі міститься 21 % кисню. У відповідності з законом Дальтона кисень створює парціальний тиск 0,21*P0, де P0 = 101325 Па (одна атмосфера). Нормальні умови передбачають температуру 0 oC (273,15 К).
Ми знаємо всі необхідні параметри для обчислення молярної концентрації кисню в повітрі. Отримуємо:
cn(O2) = P/(R *T) = 0,21*101325/(8,314*273,15) = 9,37 моль/м3.
Якщо цю концентрацію призвести до об’єму 1 літр, то ми отримаємо значення 0,009 моль/л.
Щоб зрозуміти, скільки молекул O2 міститься в 1 літрі повітря, слід помножити розраховану концентрацію на число NA. Виконавши цю процедуру, отримаємо величезне значення: N(O2) = 5,64*1021 молекул.