Початок вивчення будови атома
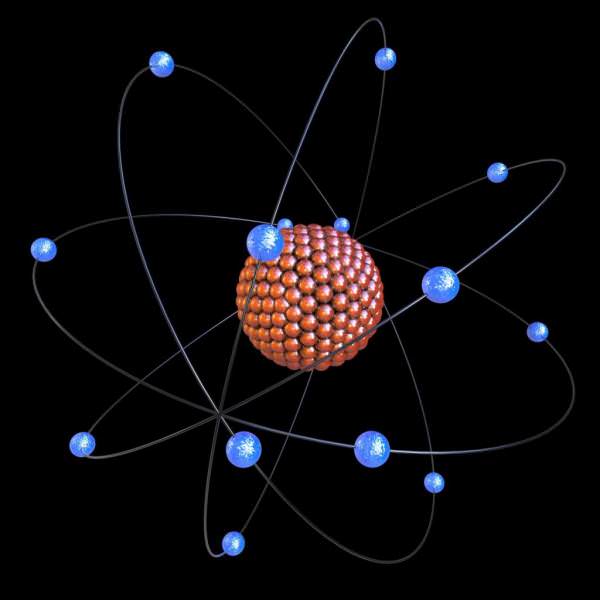
На початку XX століття допомогою дослідів з електрикою був відкритий атом. Він вважався электронейтральным, але мав позитивні і негативні складові частинки. Вчені хотіли з’ясувати їх розподіл всередині атома. Було запропоновано кілька моделей, одна з яких навіть мала назву «булочка з родзинками». Британський фізик Ернест Резерфорд провів досвід, який показав, що в центрі атома розташоване позитивне ядро, а негативний заряд знаходиться в маленьких електронах, що обертаються навколо нього.
Відкриття енергетичного рівня в хімії стало великим проривом у вивченні будови речовин і явищ.
Енергетичний рівень
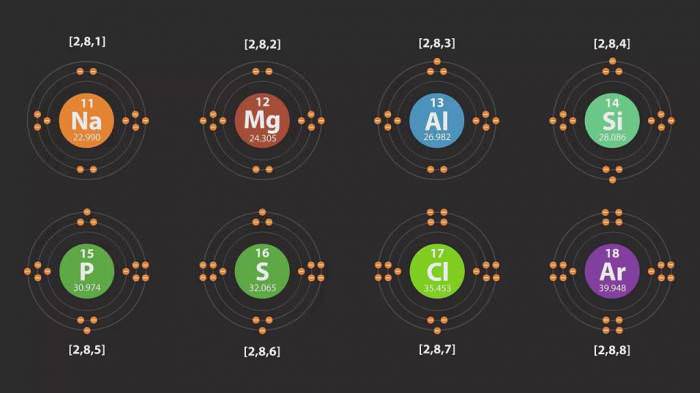
В ході вивчення властивостей хімічних речовин з’ясувалося, що кожен елемент має свої рівні. Наприклад, у кисню схема будови одна, а у азоту зовсім інша, хоча номери їх атомів різні лише на одиницю. Так що таке енергетичний рівень? Це електронні шари, що складаються з електронів, які утворюються внаслідок різної сили їх тяжіння до ядра атома. Одні знаходяться ближче, а інші – далі. Тобто верхні електрони «тиснуть» на нижні.
Число енергетичних рівнів в хімії дорівнює номеру періоду в Періодичній таблиці Менделєєва Д. І.. Найбільша кількість електронів, які знаходяться на даному енергетичному рівні, визначається по наступній формулі: 2n2, де n – номер рівня. Таким чином, на першому енергетичному рівні може бути розміщено не більше двох електронів, на другому – не більше восьми, на третьому – вісімнадцяти і так далі.
У кожного атома є рівень, що знаходиться від його ядра далі інших. Він є крайнім, останнім, і називається зовнішнім енергетичним рівнем. Число електронів на ньому для елементів головних підгруп дорівнює номеру групи.
Для побудови схеми атома і його енергетичних рівнів в хімії потрібно дотримуватися такого плану:
- визначте число всіх електронів атома даного елемента, яка дорівнює його порядковому номеру;
- визначте число енергетичних рівнів за номером періоду;
- визначте число електронів на кожному енергетичному рівні.
Приклади схем будови енергетичних рівнів деяких елементів дивіться нижче.