Приклади по темі
Завдання №1. Ідеальний одноатомний газ переходить із стану 1 в стан 2. Маса газу при цьому залишається постійною (закрита система). Необхідно визначити зміну внутрішньої енергії середовища, якщо перехід є изобарным при тиску, що дорівнює одній атмосфері. Дельта об’єму посудини з газом склала три літри.
Випишемо формулу для зміни внутрішньої енергії U:
ΔU = 3 / 2 * n * R * T.
Скориставшись рівнянням Клапейрона-Менделєєва, цей вираз можна переписати у вигляді:
ΔU = 3 / 2 * P * ΔV.
Тиск і зміна обсягу нам відомо з умови задачі, тому залишається перевести їх значення в СІ і підставити в формулу:
ΔU = 3 / 2 * 101325 * 0,003 ≈ 456 Дж.
Таким чином, коли одноатомний ідеальний газ переходить із стану 1 в стан 2, його внутрішня енергія зростає на 456 Дж.
Завдання №2. Ідеальний одноатомний газ в кількості 2 міль знаходився в посудині. Після ізохорний нагріву його енергія зросла на 500 Дж. Як змінилася при цьому температура системи?
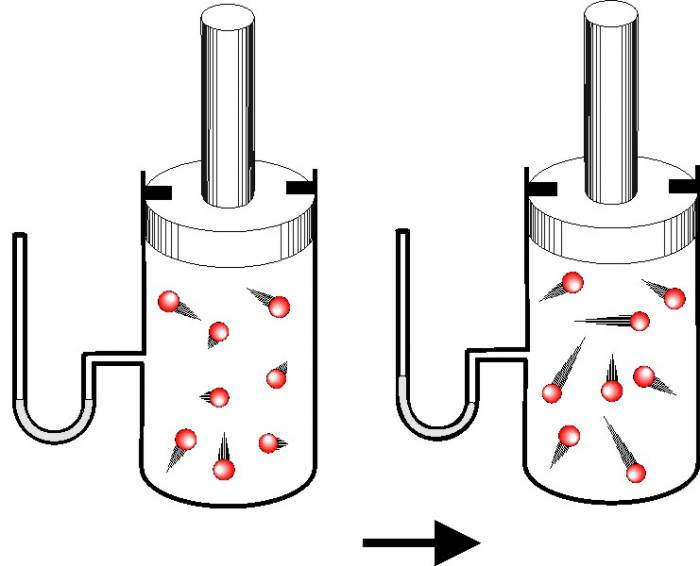
Знову випишемо формулу для зміни величини U:
ΔU = 3 / 2 * n * R * T.
З неї нескладно виразити величину зміни абсолютної температури T, маємо:
ΔT = 2 * ΔU / ( 3 * n * R ).
Підставляючи дані для ΔU і n з умови, отримуємо відповідь: T = +20 К.
Важливо розуміти, що всі наведені розрахунки справедливі тільки для одноатомного ідеального газу. Якщо система утворена багатоатомними молекулами, то формула для U вже буде не вірна. Закон Клапейрона-Менделєєва справедливий для будь-якого ідеального газу.