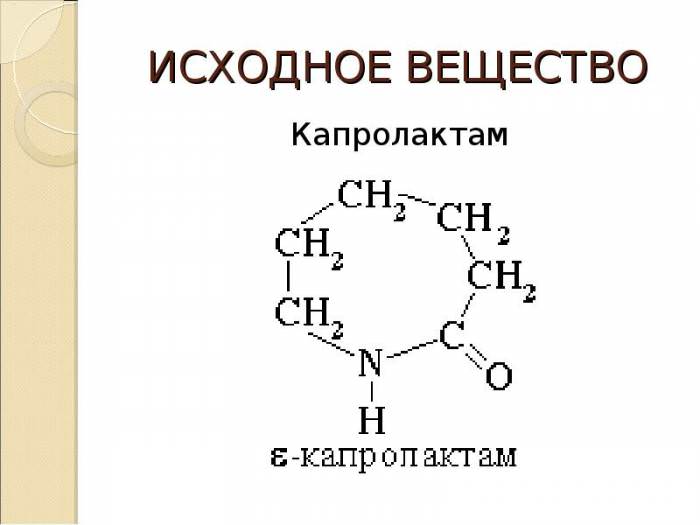
Термодинамічні параметри ідеальних газів
Існує три основних параметри для опису ідеальних газів і одна додаткова макроскопічна характеристика. Перерахуємо їх:
Далі в статті буде наведена формула рівняння Клапейрона, в якій присутні всі чотири описаних характеристики ідеального газу.
Універсальне рівняння стану
Рівняння стану ідеального газу Клапейрона прийнято записувати у такій формі:
P*V = n*R*T
Рівність показує, що добуток тиску на об’єм повинно бути пропорційно добутку температури на кількість речовини для будь-якого ідеального газу. Величина R називається універсальною газовою сталою і одночасно коефіцієнтом пропорційності між основними макроскопічними характеристиками системи.
Слід відзначити важливу особливість цього рівняння: воно не залежить від хімічної природи і складу газу. Саме тому його часто називають універсальним.

Вперше це рівність було отримано в 1834 році французьким фізиком і інженером Емілем Клапейроном в результаті узагальнення експериментальних законів Бойля-Маріотта, Шарля і Гей-Люссака. Однак Клапейрона використав кілька незручну систему констант. Згодом усі константи Клапейрона були замінені на одну єдину величину R. Зробив це Дмитро Іванович Менделєєв, тому записане вираз називають формулою рівняння Клапейрона-Менделєєва.