Кінетична теорія газів
Описана вище модель ідеальних газів властивості газів визначає однозначно. Вперше ця модель була запропонована Данилом Бернуллі в 1738 році.

Згодом її розвинули до сучасного стану Серпень Крениг, Рудольф Клаузіус, Михайло Ломоносов, Джеймс Максвелл, Людвіг Больцман, Маріан Смолуховский та інші вчені.
Кінетична теорія сипучих субстанцій, на підставі якої побудовано модель ідеального газу, пояснює два важливих макроскопічних властивості системи на підставі мікроскопічного поведінки:
- Тиск в газах є результатом зіткнення частинок зі стінками посудини.
- Температура в системі – це результат прояву постійного руху молекул і атомів.
Розкриємо детальніше обидва виведення кінетичної теорії.
Тиск газу
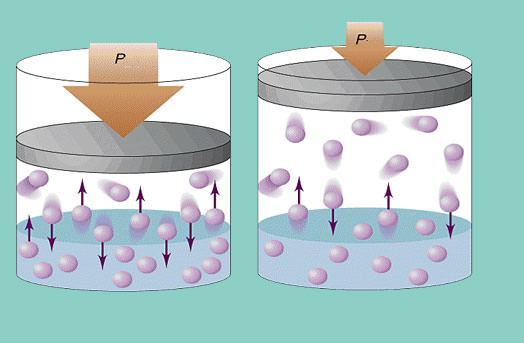
Модель ідеального газу передбачає постійне хаотичне переміщення частинок в системі і їх постійне зіткнення зі стінками посудини. Кожне таке зіткнення вважається абсолютно пружним. Маса частинки невелика (≈10-27-10-25 кг). Тому створити великий тиск при зіткненні вона не може. Тим не менш кількість частинок, а значить, і зіткнень величезна (≈1023). Крім того, середня квадратична швидкість елементів становить кілька сотень метрів в секунду при кімнатній температурі. Все це призводить до створення на стінки посудини відчутного тиску. Його можна обчислити за такою формулою:
P = N * m * vcp2 / (3 * V),
де vcp – середня квадратична швидкість, m – маса частинки.