Ізобарний і ізохорний переходи
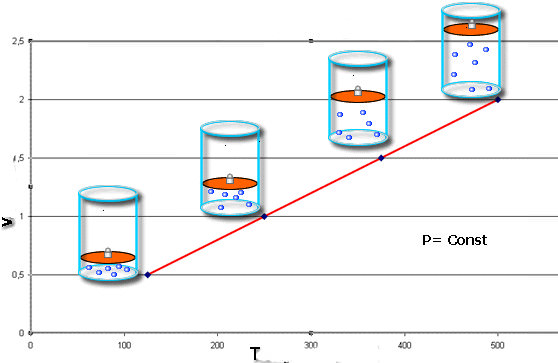
Ізобарний (при постійному тиску) і ізохорний (при незмінному обсязі) переходи в газах були вивчені на початку XIX століття. Великі заслуги у вивченні та відкриття відповідних законів належить французам Жаку Шарлю і Гей-Люссаку. Обидва процесу математично представляються наступним чином:
V/T = const при P = const;
P/T = const при V = const
Обидва вирази випливають з рівняння стану, якщо покласти відповідний параметр постійним.
Ми об’єднали ці переходи в межах одного пункту статті тому, що вони мають однакове графічне представлення. На відміну від ізотерми, изобар і изохора – це прямі лінії, які показують пряму пропорційність між об’ємом і температурою і тиском і температурою відповідно.
Адіабатичний процес
Він відрізняється від описаних изопроцессов тим, що протікає в повній теплової ізоляції від навколишнього середовища. В результаті адіабатичного переходу газ розширюється або стискається без обміну теплом із зовнішнім середовищем. При цьому відбувається відповідна зміна його внутрішньої енергії, тобто:
dU = – P*dV
Для опису адіабатичного квазистатического процесу важливо знати дві величини: изобарную CP і изохорную CV теплоємності. Величина CP говорить про те, скільки теплоти слід повідомити системі, щоб вона збільшила свою температуру на 1 К при изобарном розширення. Величина CV означає те ж саме, тільки для нагрівання при постійному обсязі.
Рівняння цього процесу для ідеального газу називається рівнянням Пуассона. Воно параметри P та V записується так:
P*Vγ = const
Тут параметр γ називається показником адіабати. Він дорівнює відношенню величин CP та CV. Для одноатомного газу γ=1,67, для двоатомних – 1,4, якщо газ утворений більш складними молекулами, то γ=1,33.
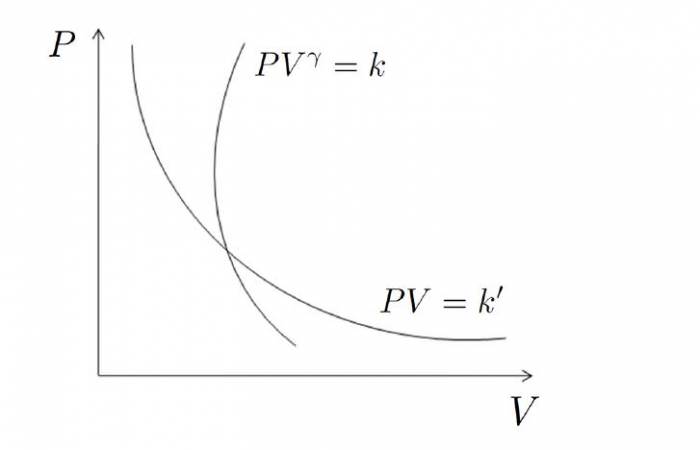
Оскільки адіабатичний процес відбувається виключно за рахунок власних внутрішніх енергетичних ресурсів, то графік адіабати в осях P-V веде себе більш різко, ніж графік ізотерми (гіпербола).