Рівняння стану і види процесів у газах
Газ є зручним агрегатним станом речовини для його вивчення в термодинаміці. Пов’язано це з тим, що для його опису існує просте рівняння, що зв’язує всі три згаданих вище термодинамічні величини. Це рівняння називається законом Клапейрона-Менделєєва. Воно має наступний вигляд:
P*V = n*R*T
З використанням цього рівняння вивчаються всі види изопроцессов і адіабатичний перехід і будуються графіки ізобари, ізотерми, изохоры і адіабати. Рівність n – це кількість речовини в системі, R – постійна для всіх газів. Нижче розглянемо всі зазначені види квазістатичних процесів.
Ізотермічний перехід
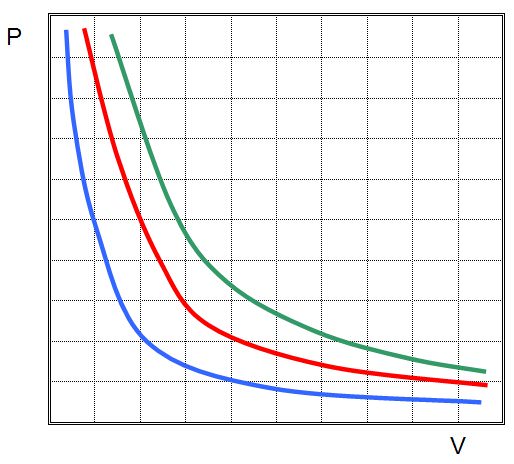
Він вперше був вивчений в кінці XVII століття на прикладі різних газів. Відповідні експерименти були поставлені Робертом Бойлем і Эдмом Мариотто. Вчені прийшли до наступного результату:
P*V = const при T = const
Якщо збільшувати тиск в системі, то її обсяг буде зменшуватися пропорційно цьому збільшення, якщо в системі температура підтримується постійною. Нескладно отримати цей закон з рівняння стану самостійно.
Ізотерма на графіку являє собою гіперболу, яка наближається до осей P і V.