Термодинаміка – це важливий розділ фізики, який вивчає і описує знаходяться в рівновазі або прагнуть до нього термодинамічні системи. Щоб з допомогою рівнянь термодинаміки можна було описати перехід з деякого початкового стану в кінцеве, необхідно зробити наближення квазистатического процесу. У чому полягає це наближення, і які види цих процесів бувають, розглянемо в цій статті.
Що розуміють під квазистатическим процесом?
Як відомо, термодинаміка для опису стану системи використовує набір макроскопічних характеристик, які можна виміряти експериментально. До них відносяться тиск Р, об’єм V і абсолютна температура T. Якщо всі три величини в даний момент для досліджуваної системи відомі, то говорять про те, що її стан не визначено.
Поняття квазистатического процесу передбачає наявність переходу між двома станами. В процесі такого переходу, природно, термодинамічні характеристики системи змінюються. Якщо в кожний момент часу, в процесі якого триває перехід, T, P і V відомі для системи, і вона знаходиться недалеко від свого рівноважного стану, то говорять про те, що відбувається квазистатический процес. Іншими словами, зазначений процес являє собою послідовний перехід між безліччю рівноважних станів. Він припускає, що зовнішній вплив на систему є незначним, щоб вона встигала швидко приходити до рівноваги.
Реальні процеси не є квазистатическими, тому розглянуте поняття буде ідеалізованим. Наприклад, при розширенні або стисненні газу існують турбулентні зміни та хвильові процеси в ньому, які передбачають певний час для їх загасання. Проте в ряді практичних випадків для газів, частки в яких рухаються з великими швидкостями, рівновага наступає швидко, тому різні переходи між станами них можна вважати з високою точністю квазистатическими.
Рівняння стану і види процесів у газах
Газ є зручним агрегатним станом речовини для його вивчення в термодинаміці. Пов’язано це з тим, що для його опису існує просте рівняння, що зв’язує всі три згаданих вище термодинамічні величини. Це рівняння називається законом Клапейрона-Менделєєва. Воно має наступний вигляд:
P*V = n*R*T
З використанням цього рівняння вивчаються всі види изопроцессов і адіабатичний перехід і будуються графіки ізобари, ізотерми, изохоры і адіабати. Рівність n – це кількість речовини в системі, R – постійна для всіх газів. Нижче розглянемо всі зазначені види квазістатичних процесів.
Ізотермічний перехід
Він вперше був вивчений в кінці XVII століття на прикладі різних газів. Відповідні експерименти були поставлені Робертом Бойлем і Эдмом Мариотто. Вчені прийшли до наступного результату:
P*V = const при T = const
Якщо збільшувати тиск в системі, то її обсяг буде зменшуватися пропорційно цьому збільшення, якщо в системі температура підтримується постійною. Нескладно отримати цей закон з рівняння стану самостійно.
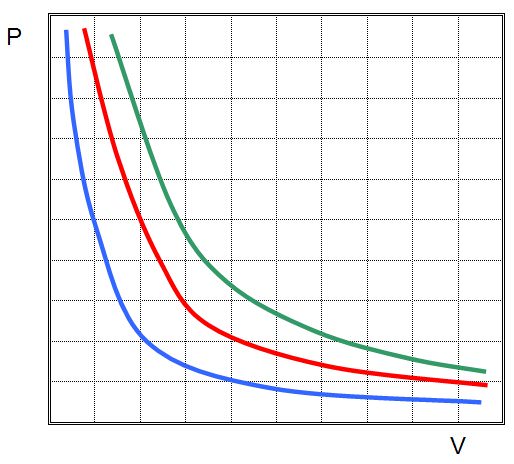
Ізотерма на графіку являє собою гіперболу, яка наближається до осей P і V.
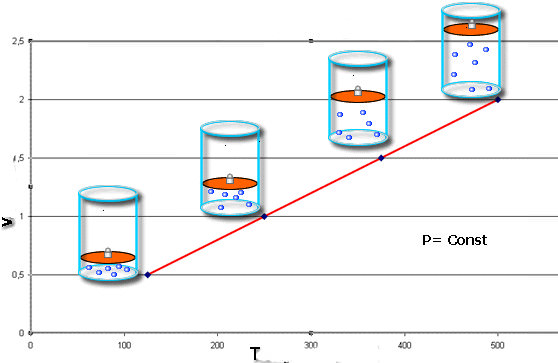
Ізобарний і ізохорний переходи
Ізобарний (при постійному тиску) і ізохорний (при незмінному обсязі) переходи в газах були вивчені на початку XIX століття. Великі заслуги у вивченні та відкриття відповідних законів належить французам Жаку Шарлю і Гей-Люссаку. Обидва процесу математично представляються наступним чином:
V/T = const при P = const;
P/T = const при V = const
Обидва вирази випливають з рівняння стану, якщо покласти відповідний параметр постійним.
Ми об’єднали ці переходи в межах одного пункту статті тому, що вони мають однакове графічне представлення. На відміну від ізотерми, изобар і изохора – це прямі лінії, які показують пряму пропорційність між об’ємом і температурою і тиском і температурою відповідно.
Адіабатичний процес
Він відрізняється від описаних изопроцессов тим, що протікає в повній теплової ізоляції від навколишнього середовища. В результаті адіабатичного переходу газ розширюється або стискається без обміну теплом із зовнішнім середовищем. При цьому відбувається відповідна зміна його внутрішньої енергії, тобто:
dU = – P*dV
Для опису адіабатичного квазистатического процесу важливо знати дві величини: изобарную CP і изохорную CV теплоємності. Величина CP говорить про те, скільки теплоти слід повідомити системі, щоб вона збільшила свою температуру на 1 К при изобарном розширення. Величина CV означає те ж саме, тільки для нагрівання при постійному обсязі.
Рівняння цього процесу для ідеального газу називається рівнянням Пуассона. Воно параметри P та V записується так:
P*Vγ = const
Тут параметр γ називається показником адіабати. Він дорівнює відношенню величин CP та CV. Для одноатомного газу γ=1,67, для двоатомних – 1,4, якщо газ утворений більш складними молекулами, то γ=1,33.
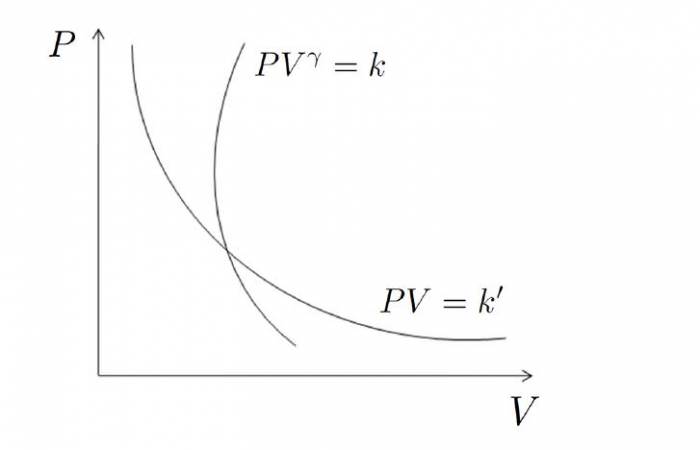
Оскільки адіабатичний процес відбувається виключно за рахунок власних внутрішніх енергетичних ресурсів, то графік адіабати в осях P-V веде себе більш різко, ніж графік ізотерми (гіпербола).