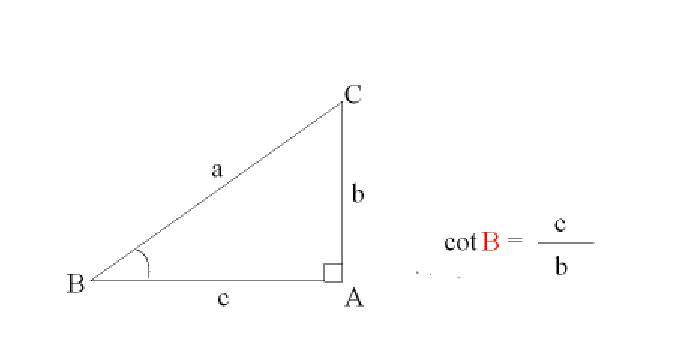
Кислоти і луги – два крайніх положення однієї шкали: їх властивості (абсолютно протилежні) обумовлює одна і та ж величина – концентрація іонів водню (H+). Однак саме по собі це число дуже незручне: навіть у кислих середовищах, де концентрація іонів водню вище, це число складає соті, тисячні частки одиниці. Тому для зручності користуються десятковим логарифмом цього значення, помноженим на мінус один. Прийнято говорити, що це pH (potentia Hydrogen), або ж водневий показник.
Виникнення поняття
Взагалі той факт, що кисле середовище і лужне середовище визначаються концентрацією іонів водню H+ і що чим вище концентрація, тим розчин більш кислий (і навпаки, чим нижче концентрація H+, тим більш лужне середовище і більша концентрація протилежних іонів OH-), був відомий науці досить давно. Однак лише в 1909 році датський хімік Серенсен вперше опублікував дослідження, в яких користувався поняттям водневого показника – PH, згодом замінили на pH.