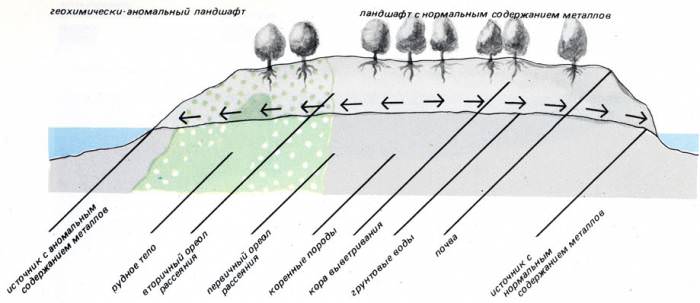
Изопроцесс при постійному тиску
Він називається изобарным переходом. На практиці його легко отримати, якщо нагрівати будь газ у циліндрі з рухомим поршнем. В результаті нагріву система збільшує свій об’єм і температуру, зберігаючи незмінним тиск.
Формула для изобарного процесу носить назву закону Шарля і виглядає наступним чином:
V/T = const.
Постійна в правій частині рівності однозначно визначається, якщо відомі кількість молекул або атомів у системі і тиск.
Закон Шарля встановлює пряму пропорційність між температурою й об’ємом з позитивним кутом нахилу, тому для досліджуваного ізопроцесів графік являє собою пряму лінію. В якості прикладу нижче наведено довільна изобар.
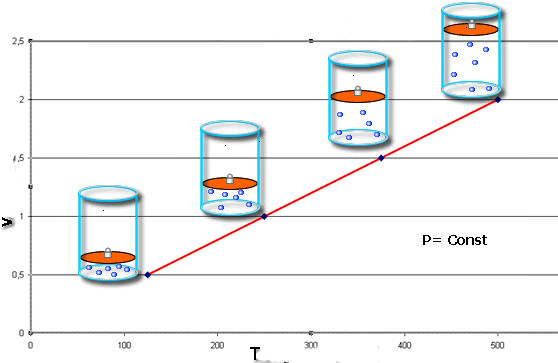
Нагрівання та охолодження при постійному об’ємі
Позначений у назві цього пункту процес є изохорным. Обсяг в такому разі виявляється фіксованим, змінюються лише тиск і температура. Зміни цих величин розраховуються за допомогою наступного виразу:
P/T = const.
Постійна const залежить від об’єму системи і кількості речовини в ньому. Вираз називається законом Гей-Люссака. Відповідний графік в осях P-T являє собою зростаючу лінійну залежність (див. головне фото). Збільшення об’єму системи при збереженні кількості частинок в ній призводить до наближення до осі температур изохоры.
Наведені в статті формули і графіки изопроцессов справедливі тільки в тому випадку, якщо вивчається система з хорошою точністю описується моделлю ідеального газу. Якщо це не так, то представлені графічні залежності будуть спотворюватися, і їх слід перебудовувати з використанням моделі Ван-дер-Ваальса для реальних газів.