Внутрішня енергія і температура
Застосовуючи положення молекулярно-кінетичної теорії ідеального газу, можна отримати наступну формулу зв’язку між середньою кінетичною енергією однієї частинки і абсолютною температурою:
m*v2/2 = 1/2*kB*T.
Тут kB – стала Больцмана. Підставляючи це рівність у формулу для U, отриману в пункті вище, приходимо до наступного виразу:
U = z/2*N*kB*T.
Цей вираз можна переписати через кількість речовини n і газову сталу R в наступному вигляді:
U = z/2*n*R *T.
Згідно з цією формулою, зміна внутрішньої енергії газу можливо, якщо змінити його температуру. Величини U і T залежать один від одного лінійно, тобто графік функції U(T) являє собою пряму лінію.
Як будову газової частинки впливає на внутрішню енергію системи?
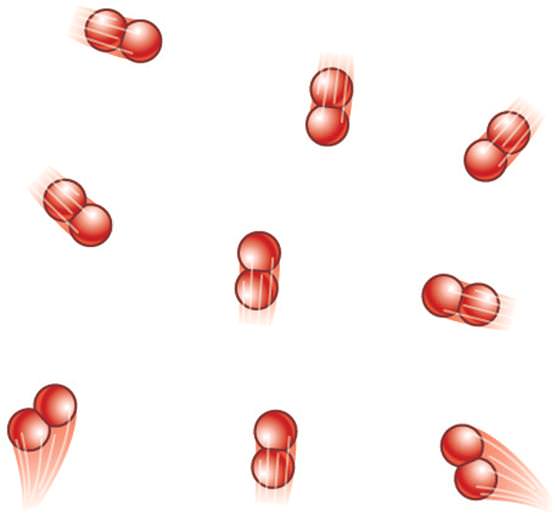
Під будовою частинки газу (молекули) мається на увазі кількість атомів, яка її складає. Воно відіграє визначальну роль при підстановці відповідного ступеня свободи z у формулу для U. Якщо газ є одноатомным, формула внутрішньої енергії газу приймає такий вигляд:
U = 3/2*n*R*T.
Звідки взялася величина z=3? Її поява пов’язана лише з трьома ступенями свободи, якими володіє атом, оскільки він може рухатися тільки в одному з трьох просторових напрямків.
Якщо розглядається двухатомная молекула газу, внутрішню енергію слід обчислювати за такою формулою:
U = 5/2*n*R*T.
Як бачимо, двухатомная молекула вже має 5 ступенів свободи, 3 з яких є поступальними і 2 обертальними (згідно з геометрії молекули, вона може обертатися навколо двох взаємно перпендикулярних осей).
Нарешті, якщо газ є трьох – і більше атомним, то справедливо наступне вираз для U:
U = 3*n*R*T.
Складні молекули мають 3 поступальних і 3 обертальних ступенів свободи.