Танака і Івасакі
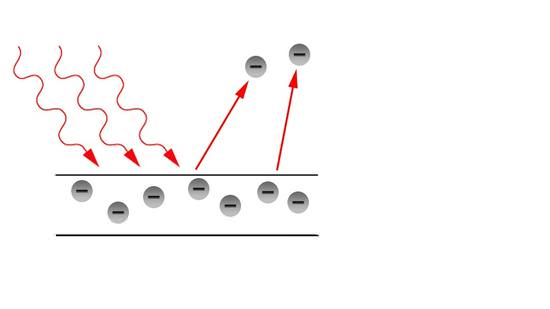
Історія кондуктометричного методу аналізу була продовжена двома знаковими японськими вченими. Танака і Івасакі вивчали процес зародження частинок AgCl і AgBr з використанням методу зупиненого потоку в поєднанні з багатоканальним спектрофотометром, який корисний для швидкого вивчення процесу порядку мсек. Вони виявили, що деякий специфічний комплекс галогеніду срібла AgXm (м-1), що має досить вузьку смугу поглинання УФ-випромінювання, утворювався миттєво при змішуванні розчину AgC104 порядку 10-4 моль дм-3 з KX (X = Cl або Br ) розчин порядку від 10-2 до 10-1 моль дм-3 з подальшим швидким розпадом близько 10 мс при утворенні проміжного продукту, що має широке УФ-поглинання і значно більш повільне зміна спектру проміжного продукту. Вони інтерпретували проміжний продукт як монодисперсные ядра (AgX) n, які складаються з n молекул, і визначили n з очевидного відносини -dC / dt α Cn при t = 0 для різних початкових концентрацій C попередника AgXm ( m-1) – (n = 7-10 для AgCl; n = 3-4 для AgBr).

Однак, оскільки попередник AgXm (m − 1) розпадається нестаціонарним чином, теорія квазистационарного зародкоутворення не застосовується в цьому процесі, і, таким чином, отримане значення n не відповідає n * значення критичних ядер. Якщо проміжний продукт містить монодисперсные ядра n, утворені за рахунок мономерного комплексу, співвідношення -dC / dt α C може не зберігатися. Якщо тільки ми не припустимо, що кластери, менші, ніж n-заходи, знаходяться в рівновазі, ki − 1, ici − 1c1 = ki, i − 1ci, один з одним в послідовної реакції c1 → c2 → c3 →… → cn − 1 → cn., і тільки останній крок cn − 1 → cn незворотній; тобто c1⇌c2⇌c3⇌… ⇌cn − 1 → cn.
Крім того, слід припускати, що концентрації кластерів від 2 до n-1 мають пренебрежимо малі рівноважні концентрації. Однак здається, немає підстав для виправдання цих припущень. З іншого боку, ми спробували розрахувати радіуси критичних ядер і коефіцієнти пересичення S в кінці швидкого процесу, використовуючи γ = 101 мДж м − 2 для кубічного AgCl19 і γ = 109 мДж м − 2 для кубічного AgBr20 в припущенні, що отримані таким чином значення n, 7-10 для AgCl19 і 3-4 для AgBr20, еквівалентні розміром монодисперсных ядер, n *. Кондуктометрическим метод аналізу, відгуки на який коливаються від схвальних до захоплених, дав нове народження хімії як науки.
У результаті вчені відкрили таку формулу: r * = 0,451 нм і S = 105 для AgCl з n * = 9; r * = 0,358 нм і S = 1230 для AgBr з n * = 4. Оскільки їх системи порівнянні з системами Девіса і Джонса, які отримали критичне пересыщение AgCl близько 1,7-2,0 при 25 °C. За допомогою кондуктометрії при прямому змішуванні у рівних обсягах розбавлених водних розчинів agno 3 і KCl, надзвичайно високі значення S можуть не відображати фактичні коефіцієнти пересичення в рівновазі з проміжними ядрами.