Принцип Авогадро
В 1810 році, експериментуючи з різними газами, Амедео Авогадро прийшов до дивовижного висновку. Виявилося, що займаний газом обсяг є функцією тільки кількості речовини при певному тиску і температурі. Не важливо, з яких молекул і атомів складається газова система, 1 моль будь-якого газу завжди займає один і той же обсяг, якщо P=const і T=const.
Зрозуміти викладений принцип не складно, якщо звернутися знову до універсального рівняння для ідеального газу. Маємо:
V/n = R*T/P = const при P=const, T=const
Розглянутий процес є ізобарно-ізотермічних.
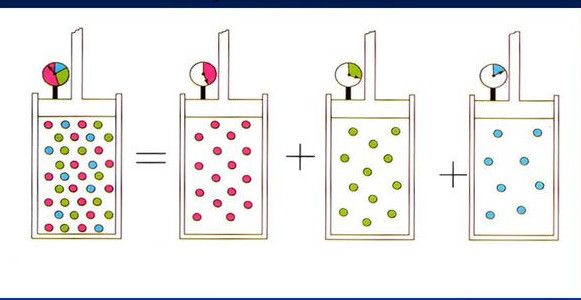
Принцип Авогадро покладений в основу закону Дальтона. Якщо проводити змішання двох ідеальних газів при постійній температурі в посудині з деяким фіксованим обсягом, то абсолютний тиск в системі буде дорівнює сумі парціальних тисків кожного компонента. У свою чергу парціальний тиск компонента прямо пропорційно атомної частці його часток у суміші:
P = ∑i=1m(Pi) = R*T/V*∑i=1m(ni)
Тут m – кількість компонент суміші. Процес змішування газів є изохорно-ізотермічним.