Важливим розділом фізики є термодинаміка. Вона вивчає різні переходи між станами системи. Простіше всього з математичної точки зору досліджувати процеси, в яких один з термодинамічних параметрів є фіксованим. У цій статті докладно розглянемо питання, що це – ізотермічний процес.
Термодинамічна система
Системою в термодинаміці прийнято називати деяку сукупність складових її елементів, які можуть обмінюватися між собою енергією. Як правило, цими елементами є атоми і молекули. Система знаходиться в термодинамічній рівновазі, коли всі її макроскопічні характеристики не змінюються в часі.
Системи бувають відкриті, закриті та ізольовані. У відкритих відбувається обмін енергією і речовиною з зовнішнім середовищем, в закритих системах можливий тільки обмін енергією з навколишнім середовищем. Нарешті, ізольовані системи повністю надані самим собі. Їх енергія і кількість речовини зберігаються з плином часу.

Зазначимо, що поняття термодинамічної системи не пов’язано з агрегатним станом матерії. Так, вода і водяна пара в закритій посудині або лід плаває в склянці з водою, є прикладами термодинамічних систем, в яких в рівновазі одночасно знаходяться два агрегатних стани одного і того ж хімічного речовини.
Термодинамічні параметри
Щоб мати можливість описувати стан термодинамічної системи та його зміну, у фізиці використовують такі параметри, як тиск P, температури T і об’єм V. Всі вони є експериментально вимірюваними величинами. Так, тиск визначають барометром (одиниця виміру – паскалі), температуру – термометром (одиниця виміру – кельвины), об’єм визначають, виходячи з форми та лінійних розмірів об’єкта (одиниця виміру – кубічні метри).

Розглянуті величини (P, T, V) людство вимірював з давніх часів, користуючись різними емпіричними методами і методами порівняння (гаряче – холодне, велике-маленьке). Лише з приходом Нового часу багато вчених Європи стали підходити до питання виміру макроскопічних параметрів з наукової точки зору. Розвиток у XVIII-XIX століттях молекулярно-кінетичної теорії газів і рідин дозволило зв’язати макроскопічні термодинамічні характеристики з мікроскопічними параметрами системи.
Що це – ізотермічний процес?
Тепер настав час відповісти на основне питання статті. Відповісти на питання, що це – ізотермічний процес, не представляє великої складності. Так називають будь-який перехід між двома станами системи, при якому абсолютна температура залишається постійною і не змінюється. Наприклад, якщо повільно збільшувати обсяг газу в циліндрі за допомогою переміщення поршня, то такий тепловий процес буде ізотермічним (тепловий обмін з навколишнім середовищем при повільному розширенні газу буде підтримувати постійною його температуру).
Наведений вище приклад не є єдиним. Розглядаючи, що це – ізотермічний процес, слід відзначити наступні важливі приклади, які описують зміну стану системи при постійній температурі:
- ізотермічне розширення і стиснення ідеального газу;
- суміш ідеальних газів при постійній температурі;
- переходи між агрегатними станами.
Розглянемо кожен із них докладніше в статті.
Закон Бойля-Маріотта
У другій половині XVII століття англієць Роберт Бойль і француз Эдм Маріотт незалежно один від одного експериментально встановили наступне відношення для газових систем:
P*V = const.
В експериментах вони використовували різні гази. При цьому добуток тиску на об’єм завжди залишалося постійним. Це рівняння називається законом Бойля-Маріотта. Графічно функція P(V) являє собою гіперболічної залежність.
Ми тільки що розглянули ізотермічний процес в ідеальному газі. Зрозуміти вираз вище нескладно, якщо згадати, як виглядає універсальне рівняння стану для газової системи:
P*V = n*R*T
Так як T=const, n – це кількість речовини, яка також не змінюється, оскільки система є закритою, R – універсальна газова постійна, то права частина універсального рівняння для розглянутого процесу є постійною, а отже, ліва частина також не змінюється.

Принцип Авогадро
В 1810 році, експериментуючи з різними газами, Амедео Авогадро прийшов до дивовижного висновку. Виявилося, що займаний газом обсяг є функцією тільки кількості речовини при певному тиску і температурі. Не важливо, з яких молекул і атомів складається газова система, 1 моль будь-якого газу завжди займає один і той же обсяг, якщо P=const і T=const.
Зрозуміти викладений принцип не складно, якщо звернутися знову до універсального рівняння для ідеального газу. Маємо:
V/n = R*T/P = const при P=const, T=const
Розглянутий процес є ізобарно-ізотермічних.
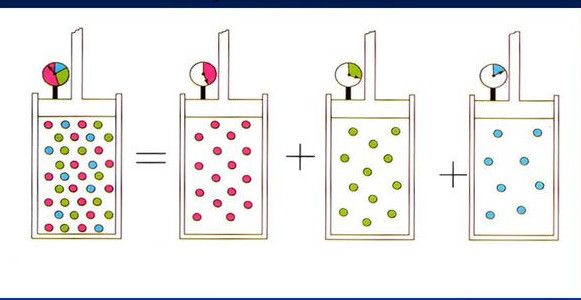
Принцип Авогадро покладений в основу закону Дальтона. Якщо проводити змішання двох ідеальних газів при постійній температурі в посудині з деяким фіксованим обсягом, то абсолютний тиск в системі буде дорівнює сумі парціальних тисків кожного компонента. У свою чергу парціальний тиск компонента прямо пропорційно атомної частці його часток у суміші:
P = ∑i=1m(Pi) = R*T/V*∑i=1m(ni)
Тут m – кількість компонент суміші. Процес змішування газів є изохорно-ізотермічним.
Перехід між агрегатними станами речовини

Мова йде про процеси плавлення твердого тіла або кристалізації рідини, про процеси кипіння рідини або конденсації газу. Всі ці переходи відбуваються або з виділенням, або поглинанням тепла. Так, в результаті кристалізації молекули рідини втрачають енергію, виділяючи її в навколишнє середовище. Останнє призводить до зменшення кінетичної енергії молекул і формування з них певної структури (аморфної, кристалічної). Навпаки, плавлення є ендотермічним процесом, тобто він йде з поглинанням теплоти. Ця теплота витрачається на руйнування хімічних зв’язків між молекулами і атомами в твердому тілі.
Будь-який перехід між агрегатними станами матерії – це ізотермічний процес, тобто він здійснюється при постійній температурі. Наприклад, всім відомо, що чистий лід плавиться при 0 oC, але при 0 oC також відбувається кристалізація води.
Визначення теплового ефекту переходу між агрегатними станами

Всі термодинамічні розрахунки процесів кристалізації, плавлення, конденсації і кипіння проводяться з використанням наступної формули:
Q = λ*m
Тут Q – кількість теплоти, яка виділяється або поглинається в результаті перетворення m кілограм речовини з одного агрегатного стану в інше. Величина λ – це константа теплового процесу, назва якої залежить від конкретного перетворення. Наприклад, у разі плавлення вона називається питомою теплотою плавлення. Вимірюється λ Дж/кг.