Що таке изопроцессы в газах?
Під цими процесами розуміють переходи між двома різними станами газу (початковим і кінцевим), в результаті яких зберігаються одні величини і змінюються інші. Виділяють три типи ізопроцесів в газах:
- ізотермічний;
- ізобарний;
- ізохорний.

Важливо відзначити, що всі вони були експериментально вивчені і описані в період з другої половини XVII ст. і до 30-х років XIX століття. На підставі цих експериментальних результатів Еміль Клапейрон в 1834 році отримав рівняння, універсальне для газів. Дана ж стаття побудована навпаки – застосовуючи рівняння стану, отримаємо формули для изопроцессов в ідеальних газах.
Перехід при постійній температурі
Він називається ізотермічним процесом. З рівняння стану ідеального газу випливає, що при постійній абсолютній температурі в закритій системі повинно залишатися постійним добуток об’єму на тиск, тобто:
P*V = const
Цю залежність дійсно спостерігали Роберт Бойль і Эдм Маріотт у другій половині XVII століття, тому в даний час записане рівність носить їх прізвища.
Функціональні залежності P(V) або V(P), виражені графічно, мають вигляд гіпербол. Чим вище температура, при якій проводять ізотермічний експеримент, тим більше добуток P*V.
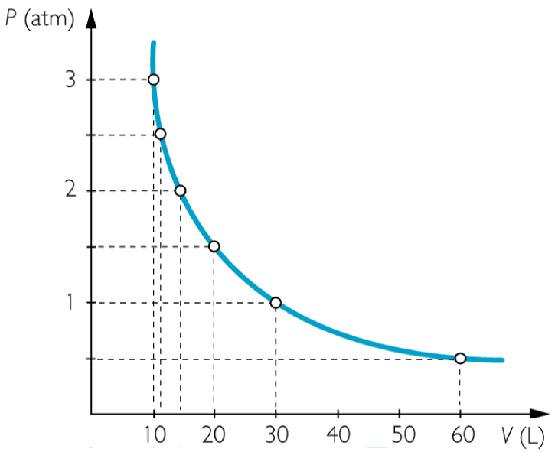
При ізотермічному процесі газ розширюється або стискається, здійснюючи роботу і не змінюючи своєї внутрішньої енергії.