Всі хімічні елементи умовно можна розділити на неметали і метали. Чи знаєте ви, за якими ознаками вони відрізняються? Як визначити їх положення в таблиці хімічних елементів? На ці та інші питання ви знайдете відповіді в нашій статті.
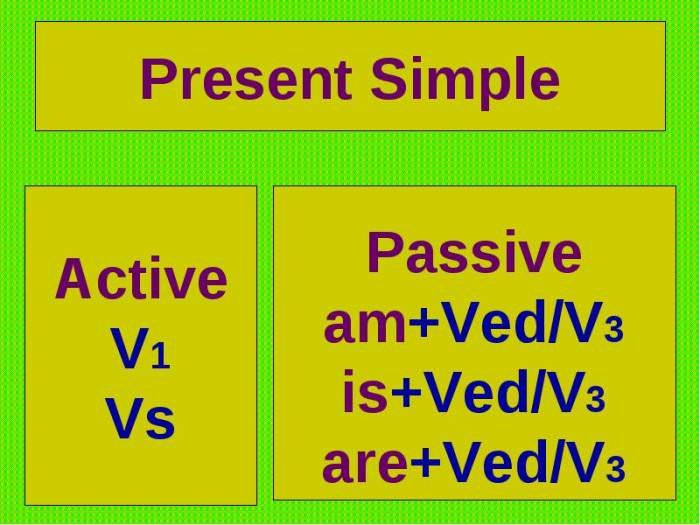
Положення неметалів і металів: таблиця Менделєєва
За зовнішніми ознаками і фізичним властивостям не завжди можна з’ясувати, до якої групи відноситься хімічний елемент. Властивості металів і неметалів можна визначити за розташуванням у періодичній таблиці.
Для цього потрібно візуально провести діагональ від бору до астата, від 5 до 85 номери. У правому верхньому куті будуть переважно перебувати неметали. Їх у таблиці меншість, всього 22 елемента. Метали знаходяться в правій частині періодичної таблиці нагорі – в основному в I, II і III групах.
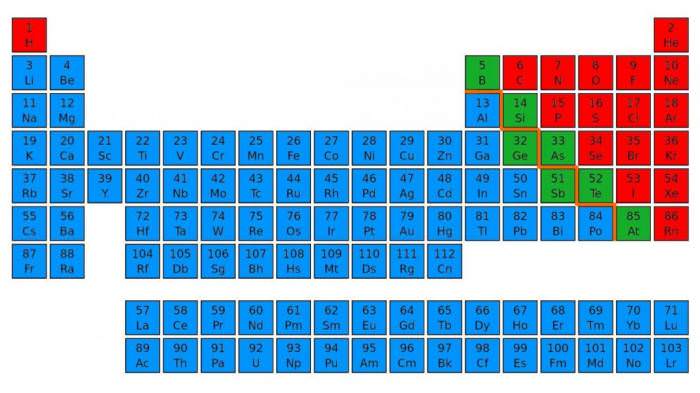
Енергетичний рівень
Відмінності неметалів і металів спочатку обумовлені будовою їх атомів. Почнемо з кількості електронів на зовнішньому енергетичному рівні. У атомів металів воно варіює від одного до трьох. Як правило, вони володіють більшим радіусом, тому атоми металів досить легко віддають зовнішні електрони, так як мають сильні відновні властивості.
У неметалів число електронів на зовнішньому рівні більше. Це пояснює їх окислювальну активність. Неметали приєднують відсутні електрони, повністю заповнюючи енергетичний рівень. Найбільш сильні окислювальні властивості проявляють неметали другого і третього періоду VI-VII груп.
Заповнений енергетичний рівень містить 8 електронів. Найбільшою окислювальною здатністю володіють галогени з валентністю I. Серед них лідирує фтор, так як у цього елемента немає вільних орбіталей.