Окремі випадки рівняння стану
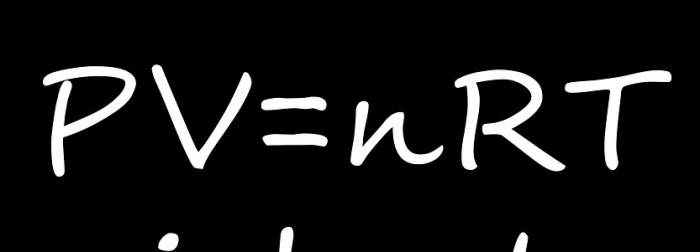
Існує 4 приватних закону, які випливають з рівняння стану ідеального газу. Зупинимося коротко на кожному з них.
Якщо в закритій системі з газом підтримувати постійну температуру, то будь-яке збільшення в ній тиску викличе пропорційне зменшення обсягу. Цей факт може бути записаний математично в такому вигляді:
P * V = const при T, n = const.
Цей закон носить прізвища вчених Роберта Бойля і Эдма Маріотта. Графіком функції P(V) є гіпербола.
Якщо в закритій системі зафіксувати тиск, то будь-яке збільшення температури в ній призведе до пропорційного зростання обсягу, тобто:
V / T = const при P, n = const.
Описаний цим рівнянням процес називається изобарным. Він носить прізвища французьких вчених Шарля і Гей-Люссака.
Якщо в закритій системі об’єм не змінюється, то процес переходу між станами системи називається изохорным. Під час нього будь-яке підвищення тиску призводить до аналогічного підвищення температури:
P / T = const при V, n = const.
Це рівняння отримало назву закону Гей-Люссака.
Графіками изобарного і ізохорний процесів є прямі лінії.
Нарешті, якщо зафіксувати макроскопічні параметри (температуру і тиск), тоді всяке збільшення кількості речовини в системі призведе до пропорційного зростання його обсягу:
n / V = const при P, T = const.
Ця рівність називається принципом Авогадро. Воно лежить в основі закону Дальтона для ідеальних газових сумішей.