Кожній людині відомо, що оточують нас тіла складаються з атомів і молекул. Вони мають різну форму і структуру. При вирішенні задач з хімії та фізики часто потрібно знайти масу молекули. Розглянемо в даній статті кілька теоретичних методів вирішення даної задачі.
Загальні відомості
Перш ніж розглядати, як знайти масу молекули, слід познайомитися з самим поняттям. Далі наведемо кілька прикладів.
Молекулою прийнято називати сукупність атомів, які об’єднані між собою тим чи іншим видом хімічного зв’язку. Також вони повинні і можуть розглядатися як єдине ціле в різних фізико-хімічних процесах. Ці зв’язки можуть носити іонний, ковалентный, металевий або вандерваальсовский характер.
Всім відома молекула води має хімічну формулу H2O. Атом кисню в ній з’єднаний з допомогою ковалентних полярних зв’язків із двома атомами водню. Така будова обумовлює багато фізичні і хімічні властивості рідкої води, льоду і пари.
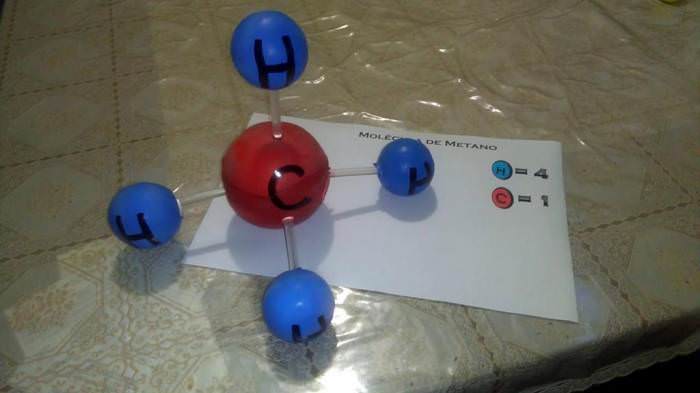
Природний газ метан – це ще один яскравий представник молекулярного речовини. Його частинки утворені атомом вуглецю і чотирма атомами водню (CH4). У просторі молекули мають форму тетраедра з вуглецем в центрі.
Повітря – складна суміш газів, яка головним чином складається з молекул кисню O2 і азоту N2. Обидва типи з’єднані міцними подвійними і потрійними ковалентными неполярними зв’язками, що зумовлює їх високу хімічну інертність.
Визначення маси молекули через її молярную масу
У періодичній таблиці хімічних елементів міститься велика кількість інформації, серед якої є атомні одиниці маси (а.е.м.). Наприклад, атом водню має а.е.м., дорівнює 1, а атом кисню – 16. Кожна з цих цифр показує масу в грамах, яку буде мати система, що містить 1 моль атомів відповідного елемента. Нагадаємо, що одиниця вимірювання кількості речовини 1 моль являє собою кількість частинок в системі, відповідне числу Авогадро NA, воно дорівнює 6,02*1023.
Коли розглядають молекулу, то користуються поняттям не а.е.м., а молекулярною масою. Остання являє собою просту суму а.е.м. для атомів, що входять до складу молекули. Наприклад, молярна маса для H2O буде дорівнює 18 г/моль, а для O2 – 32 г/моль. Маючи загальне поняття, далі можна перейти до розрахунків.
Молярную масу M просто використовувати для обчислення маси молекули m1. Для цього слід скористатися простою формулою:
m1 = M/NA.
У деяких завданнях може бути дана маса системи m і кількість речовини в ній n. В такому випадку маса однієї молекули обчислюється так:
m1 = m/(n*NA).
Ідеальний газ
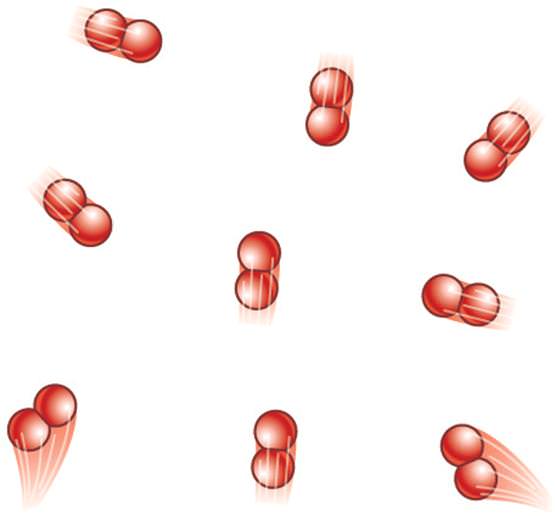
Цим поняттям називається такий газ, молекули якого хаотично рухаються в різних напрямках з великими швидкостями, одна з одною не взаємодіють. Відстані між ними набагато перевищують їх власні розміри. Для такої моделі виявляється справедливим наступне вираз:
P*V = n*R*T.
Воно носить назву закону Менделєєва-Клапейрона. Як видно, рівняння пов’язує між собою тиск Р, об’єм V, абсолютну температуру T і кількість речовини n. У формулі R – газова константа, чисельно рівна 8,314. Записаний закон називається універсальним, тому що він не залежить від хімічного складу системи.
Якщо відомі три термодинамічних параметру – T, P, V і значення m системи, то маса молекули ідеального газу m1 не складно визначити по наступній формулі:
m1 = m*R*T/(NA*P*V).
Цей вираз можна записати через щільність ρ газу та постійну Больцмана kB:
m1 = ρ*kB*T/P.
Приклад завдання
Відомо, що густина деякого газу становить 1,225 кг/м3 при атмосферному тиску 101325 Па і температурі 15 oC. Чому дорівнює маса молекули? Про який газ йде мова?
Оскільки нам дано тиск, щільність і температура системи, то можна скористатися отриманої в попередньому пункті формулою, щоб визначити масу однієї молекули. Маємо:
m1 = ρ*kB*T/P;
m1 = 1,225*1,38*10-23*288,15/101325 = 4,807*10-26 кг.
Щоб відповісти на друге запитання задачі, знайдемо молярную масу M газу:
M = m1*NA;
M = 4,807*10-26*6,02*1023 = 0,029 кг/моль.
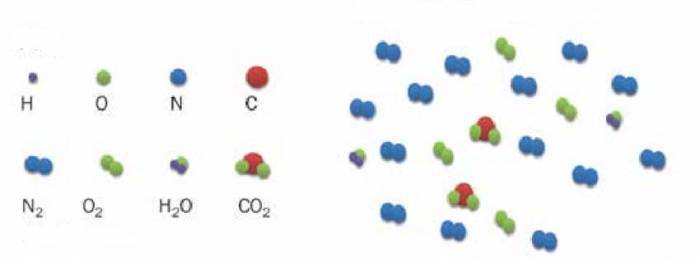
Отримане значення молярної маси газу відповідає повітрю.