Кожен школяр, який уважно вивчав таблицю Менделєєва, напевно помітив, що, крім номера хімічного елемента, в ній присутня інформація про вагу його атома. У цій статті розглянемо, що таке молярна маса і де вона використовується.
Що таке моль?
Перш ніж відповісти на питання “що таке молярна маса”, необхідно розібратися з такою важливою величиною в хімії, як міль.
У XIX столітті Амедео Авогадро, уважно вивчаючи закон Гей-Люссака для ідеальних газів при изохорном процесі, прийшов до висновку, що в однакових об’ємах різних речовин при ідентичних умовах (температура і тиск) міститься однакове число атомів або молекул. Ідеї Авогадро суперечили теорій того часу про хімічному будову і поведінку газових субстанцій, тому вони були прийняті тільки через півстоліття.
На початку XX століття за допомогою більш сучасних технологій вдалося визначити кількість молекул водню в 2 грамах цього газу. Це кількість отримало назву “моль”. Сам термін був введений Вільгельмом Оствальдом, з латини він перекладається як “купа”, “скупчення”.
У 1971 році моль став однією з 7 основних одиниць вимірювання в системі СІ. В даний час під 1 молем розуміють таку кількість атомів кремнію, яке міститься в ідеальній сфері масою 0,028085 кг. Саме число частинок, що відповідає 1 моль, називається числом Авогадро. Одно воно приблизно 6,02*1023.
Що таке молярна маса?
Тепер можна повернутися до теми статті. Міль і молярна маса – це дві взаємопов’язані величини. Під другий розуміють вагу одного моль будь-якої речовини. Очевидно, що тип хімічного елемента або складу молекули того чи іншого газу безпосередньо визначає молярную масу. Згідно з цим визначенням, можна записати наступний вираз:
M = ma * NA.
Де ma – це маса одного атома, NA – число Авогадро. Тобто для отримання величини M необхідно помножити вагу однієї частинки (молекули, атома, атомного кластера) на число Авогадро.
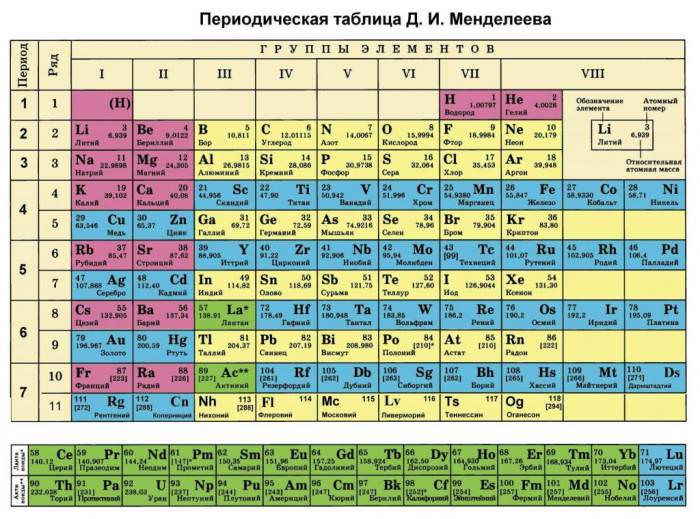
Як було зазначено у вступі статті, кожен елемент періодичної таблиці містить інформацію про його атомній масі. Вона являє собою вага в грамах на моль. Очевидно, щоб отримати молярную масу в кг/моль, слід табличне значення поділити на 1000. Наприклад, для ніобію під номером 41 ми бачимо цифру 92,9, тобто 1 моль його атомів має вагу 92,9 грама.
Де використовується величина M в хімії?
Знаючи тепер, що таке молярна маса, розглянемо, де її застосовують в хімії.
Поняття кількості речовини і молярного ваги відіграє важливу роль при складанні хімічних реакцій, оскільки вони йдуть тільки при суворому співвідношенні реагентів. Для прикладу нижче наведена реакція згоряння водню з утворенням молекули води:
2H2 + O2 = 2H2O.
Видно, що 2 моль водню, які мають масу 4 грами, реагують без залишку з 1 моль кисню вагою 32 грами. В результаті утворюється 2 моль молекул води, з показником в 36 грамів. З цих цифр зрозуміло, що в процесі хімічних перетворень маса зберігається. Насправді ж вага реагентів і продуктів перетворення трохи відрізняється. Ця невелика різниця пов’язана з тепловим ефектом реакції. Різницю в масах можна розрахувати, якщо використати формулу Ейнштейна для зв’язку ваги і енергії.
У хімії поняття молярної маси також тісно пов’язане з однойменною концентрацією. Зазвичай тверді речовини, які розчиняються в рідинах, що характеризують кількістю молей в одному літрі, тобто молярної концентрації.
Важливо розуміти, що дана величина є постійною тільки для даного хімічного елемента або конкретного з’єднання, наприклад, для H2 вона дорівнює 2 г/моль, а для O3 – 48 г/моль. Якщо її значення для одного з’єднання більше, ніж для іншого, то це означає, що сама елементарна частинка першого речовини має більшу масу, ніж другого.
Гази та їх молярний об’єм
Молярна маса також пов’язана з фізикою ідеальних газів. Зокрема, їй користуються під час визначення обсягу газової системи за конкретних зовнішніх умов, якщо відомо кількість речовини.

Ідеальні гази описуються рівнянням Клапейрона-Менделєєва, яке має вигляд:
P * V = n * R * T.
Тут n – це кількість речовини, яка з молярної масою пов’язано так:
n = m / M.
Обсяг газу можна визначити, якщо відомі його m, температура T і тиск P, за наступною формулою:
V = m * R * T / (M * P).
Молярним об’ємом називається такий, який при 0 oC і тиску в одну атмосферу займає 1 моль будь-якого газу. З формули вище можна розрахувати цю величину, вона становить 22,4 літра.