Агрегатний стан матерії, в якому кінетична енергія частинок набагато перевищує їх потенційну енергію взаємодії, називається газом. Фізику подібних речовин починають розглядати в старших класах шкіл. Ключовим питанням при математичному описі цієї текучою субстанції є рівняння стану ідеального газу. Детально вивчимо його в статті.
Ідеальний газ і його відмінність від реального
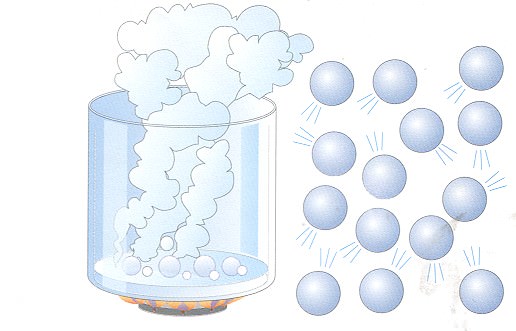
Як відомо, для будь-якого газового стану характерне хаотичний рух з різними швидкостями складових його молекул і атомів. У реальних газах, прикладом яких може служити повітря, частинки так чи інакше взаємодіють один з одним. В основному це взаємодія носить ван-дер-ваальсовый характер. Тим не менш, якщо температури газової системи високі (кімнатна і вище), а тиск не є величезним (відповідає атмосферному), ван-дер-ваальсовые взаємодії настільки малі, що не роблять впливу на макроскопічне поведінку всієї газової системи. У такому випадку говорять про ідеальний.
Збираючи викладену вище інформацію в одне визначення, можна сказати, що ідеальний газ – це система, в якій відсутні взаємодії між частинками. Самі частинки є безрозмірними, але мають певну масу, а зіткнення частинок зі стінками посудини мають пружний характер.
Практично всі гази, з якими людина стикається в побуті (повітря, природний метан в газових плитах, водяна пара) можна з задовільною для багатьох практичних проблем точністю вважати ідеальними.
Передумови появи рівняння стану ідеального газу у фізиці
Людство активно вивчало газове стан речовини з наукової точки зору протягом XVII-XIX століть. Першим законом, який описав ізотермічний процес, стало експериментально відкрите Робертом Бойлем і Эдмом Мариотто наступне співвідношення між обсягом системи V і тиском у ній P:
- P * V = const, при T = const.
Проводячи експерименти з різними газами у другій половині XVII століття, згадані вчені встановили, що залежність тиску від об’єму завжди має вигляд гіперболи.
Потім у кінці XVIII – на початку XIX століття Французькі вчені Шарль і Гей-Люссак експериментально виявили ще два газових закону, які описували математично ізобарний і ізохорний процеси. Обидва закону наведені нижче:
- V / T = const, при P = const;
- P / T = const, при V = const.
Обидва рівності свідчать про прямий пропорційності між обсягом газу і температурою, а також між тиском і температурою при збереженні постійного тиску і об’єму, відповідно.
Ще однією передумовою для складання рівняння стану ідеального газу стало відкриття Амедео Авагадро в 10-х роках XIX століття такого співвідношення:
- n / V = const, при T, P = const.
Італієць експериментально довів, що якщо збільшувати кількість речовини n, то при постійних температурі і тиску обсяг буде лінійно зростати. Найдивовижніше полягало в тому, що різні за своєю природою гази при однакових тисках і температурах займали один і той же обсяг, якщо їх кількість збігалося.
Закон Клапейрона-Менделєєва

В 30-е роки XIX століття француз Еміль Клапейрон опублікував роботу, в якій навів рівняння стану ідеального газу. Воно трохи відрізнялася від сучасної форми. Зокрема, Клапейрона використовував певні константи, виміряні експериментально його попередниками. Через кілька десятиліть наш співвітчизник Д. І. Менделєєв замінив константи Клапейрона однією єдиною – універсальної газової сталої R. В результаті універсальне рівняння набуло сучасного вигляду:
- P * V = n * R * T.
Неважко здогадатися, що це воно є простим об’єднанням формул газових законів, які були записані вище в статті.
Постійна R в цьому виразі має цілком конкретний фізичний зміст. Вона показує роботу, яку виконає 1 моль газу, якщо він буде розширюватися при збільшенні температури на 1 кельвін (R = 8,314 Дж/(моль*К)).

Інші форми запису універсального рівняння
Крім записаної вище форми універсального рівняння стану ідеального газу, існує рівняння стану, які використовують інші величини. Наведемо їх нижче:
- P * V = m / M * R * T;
- P * V = N * kB * T;
- P = ρ * R * T / M.
В цих рівностях m – маса газу ідеального, N – число частинок в системі, ρ – густина газу, M – значення молярної маси.
Нагадаємо, що записані вище формули справедливі тільки в разі використання одиниць системи СІ для всіх фізичних величин.
Приклад завдання
Отримавши необхідні теоретичні відомості, розв’яжемо наступну задачу. Чистий азот знаходиться при тиску 1,5 атм. у балоні, обсяг якого становить 70 літрів. Необхідно визначити кількість молів ідеального газу і його масу, якщо відомо, що він знаходиться при температурі 50 °C.
Для початку запишемо всі одиниці вимірювання в СІ:
1) P = 1,5 * 101325 = 151987,5 Па;
2) V = 70 * 10-3 = 0,07 м3;
3) T = 50 + 273,15 = 323,15 К.
Підставимо тепер ці дані в рівняння Клапейрона-Менделєєва, отримаємо значення кількості речовини:
- n = P * V / (R * T) = 151987,5 * 0,07 / (8,314 * 323,15) = 3,96 моль.
Для визначення маси азоту слід згадати його хімічну формулу та показати значення молярної маси в таблиці Менделєєва для цього елемента:
- M(N2) = 14 * 2 = 0,028 кг/моль.
Маса газу буде дорівнювати:
- m = n * M = 3,96 * 0,028 = 0,111 кг.
Таким чином, кількість азоту в балоні дорівнює 3,96 моль, його маса становить 111 грам.