В термодинаміці при вивченні переходів з початкового в кінцевий стан деякої системи важливо знати тепловий ефект процесу. З цим ефектом тісно пов’язане поняття теплоємності. У цій статті розглянемо питання, що розуміють під изохорной теплоємність газу.
Ідеальний газ
Ідеальним називається такий газ, частинки якого вважаються матеріальними точками, тобто не мають розмірів, але володіють масою, і у якого вся внутрішня енергія складається виключно з кінетичної енергії руху молекул і атомів.
Будь-який реальний газ в ідеалі ніколи не буде задовольняти описаної моделі, оскільки його частинки все ж мають деякі лінійні розміри і взаємодіють між собою за допомогою слабких ван-дер-ваальсових зв’язків або хімічних зв’язків іншого типу. Однак при низьких тисках і високих температурах відстані між молекулами великі, а їх кінетична енергія перевищує потенційну в десятки разів. Все це дозволяє застосовувати з високою мірою точності ідеальну модель для реальних газів.
Внутрішня енергія газу
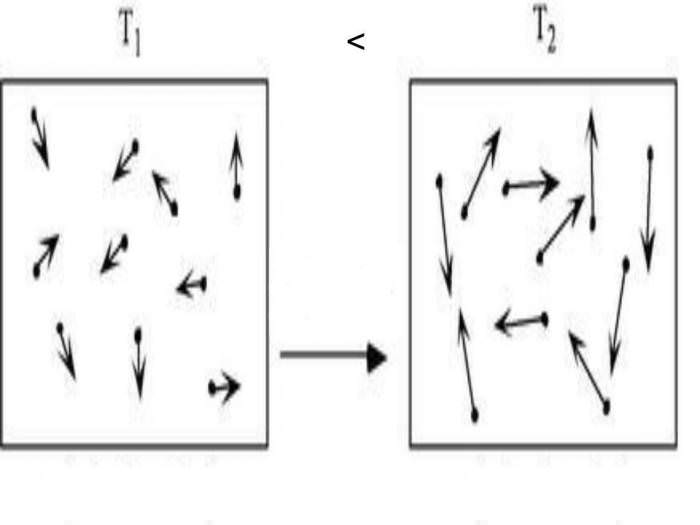
Внутрішня енергія будь-якої системи – це фізична характеристика, яка дорівнює сумі потенційної і кінетичної енергії. Оскільки в ідеальних газах можна знехтувати потенційною енергією, то для них можна записати рівність:
U = Ek.
Де Ek – кінетична енергія системи. Використовуючи молекулярно-кінетичну теорію і застосовуючи універсальне рівняння стану Клапейрона-Менделєєва, нескладно отримати вираз для U. Воно записано нижче:
U = z/2*n*R*T.
Тут T, R і n – абсолютна температура, газова постійна і кількість речовини відповідно. Величина z – ціле число, що показує кількість ступенів свободи, якими володіє молекула газу.
Ізобарна та изохорная теплоємність
У фізиці теплоємністю називається кількість теплоти, яку необхідно надати досліджуваної системі, щоб нагріти її на один кельвін. Справедливо також і зворотне визначення, тобто теплоємність – це кількість теплоти, яка система виділяє при охолодженні на один кельвін.
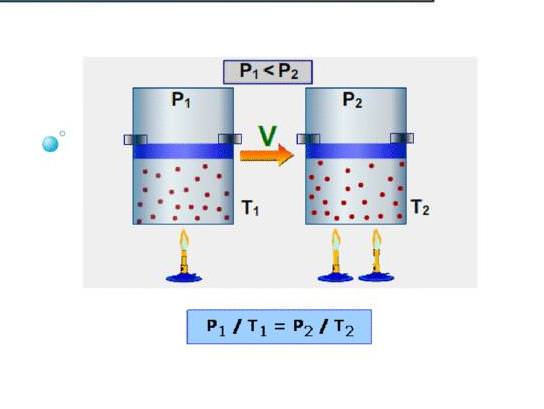
Найпростіше для системи визначити изохорную теплоємність. Під нею розуміють теплоємність при постійному об’ємі. Оскільки система в таких умовах роботу не робить, то вся енергія витрачається на підвищення внутрішніх енергетичних запасів. Позначимо изохорную теплоємність символом CV, тоді можна записати:
dU = CV*dT.
Тобто зміна внутрішньої енергії системи прямо пропорційно зміні її температури. Якщо порівняти цей вираз, із записаним в попередньому пункті рівністю, то приходимо до формули для CV в ідеальному газі:
СV = z/2*n*R.
Цією величиною на практиці незручно користуватися, оскільки вона залежить від кількості речовини в системі. Тому було введено поняття питомої изохорной теплоємності, тобто величини, яку розраховують або на 1 моль газу, або на 1 кг. Позначимо першу величину символом CVn, другу – символом CVm. Для них можна записати такі формули:
CVn = z/2*R;
CVm = z/2*R/M.
Тут M – молярна маса.
Изобарной називається теплоємність при підтримці постійного тиску в системі. Прикладом такого процесу є розширення газу у циліндрі під поршнем при його нагріванні. На відміну від ізохорний, під час изобарного процесу підводиться до системи тепло витрачається на підвищення внутрішньої енергії і на виконання механічної роботи, тобто:
H = dU + P*dV.
Ентальпія изобарного процесу являє собою твір изобарной теплоємності на зміну температури в системі, тобто:
H = CP*dT.
Якщо розглянути розширення при постійному тиску 1 моль газу, то перше початок термодинаміки запишеться у вигляді:
CPn*dT = CVn*dT + R*dT.
Останнє доданок отримано з рівняння Клапейрона-Менделєєва. З цієї рівності випливає зв’язок між изобарной і изохорной теплоемкостями:
CPn = CVn + R.
Для ідеального газу питома молярна теплоємність при постійному тиску завжди більше відповідної изохорной характеристики на величину R=8,314 Дж/(моль*К).
Ступені свободи молекул і теплоємність
Випишемо ще раз формулу для питомої молярної изохорной теплоємності:
CVn = z/2*R.
У разі одноатомного газу величина z = 3, оскільки атоми в просторі можуть переміщатися лише в трьох незалежних напрямках.
Якщо ж мова йде про газ, що складається з двоатомних молекул, наприклад, кисень O2 або водень H2, то, крім поступального руху, ці молекули можуть обертатися навколо двох взаємно перпендикулярних осей, тобто z буде дорівнювати 5.
У випадку більш складних молекул для визначення CVn слід використовувати z=6.