Навколишні природні явища і процеси є досить складними. Для їх точного фізичного опису слід застосовувати громіздкий математичний апарат і враховувати велику кількість значущих факторів. Щоб уникнути цієї проблеми, у фізиці використовують деякі спрощені моделі, які значно полегшують математичний аналіз процесу, але практично не впливають на точність його опису. Однією з них є модель ідеального газу. Розглянемо її докладніше в статті.
Поняття про ідеальному газі
Ідеальний газ – це агрегатний стан речовини, яка складається з взаємодіючих матеріальних точок. Пояснимо докладніше подібне визначення.
По-перше, мова йде про матеріальні точках як об’єкти, що становлять ідеальний газ. Це означає, що його молекули і атоми не мають розміром, але мають певну масу. Це сміливе наближення можна зробити з урахуванням того, що у всіх реальних газах при невисоких показниках тиску і великих температурах відстань між молекулами набагато перевищує їх лінійні розміри.
По-друге, молекули в ідеальному газі повинні взаємодіяти один з одним. В дійсності такі взаємодії завжди існують. Так, навіть атоми благородних газів відчувають диполь-дипольне тяжіння. Іншими словами, присутні ван-дер-ваальсовые взаємодії. Тим не менше у порівнянні з кінетичною енергією обертання і поступального переміщення молекул ці взаємодії настільки незначні, що вони не впливають на властивості газів. Тому їх можна розглядати при вирішенні практичних завдань.
Важливо відзначити, що не всі гази, щільність у яких невелика, а температура висока, можуть вважатися ідеальними. Крім ван-дер-ваальсових взаємодій існують інші, більш сильні типи зв’язків, наприклад, водневі між молекулами H2O, які призводять до грубого порушення умов ідеальності газу. З цієї причини водяна пара не є ідеальним газом, а повітря є ним.

Фізична модель ідеального газу
Цю модель можна представити наступним чином: припустимо, що газова система містить N частинок. Це можуть бути атоми і молекули різних хімічних речовин та елементів. Кількість частинок N велике, тому для його опису зазвичай використовують одиницю “моль” (1 моль відповідає числу Авогадро). Всі вони рухаються в певному обсязі V. Руху частинок є хаотичними і незалежними один від одного. Кожна з них володіє певною швидкістю v і переміщається по прямій траєкторії.
Теоретично вірогідність зіткнення між частинками практично дорівнює нулю, оскільки їх розмір невеликий в порівнянні з межчастичными відстанями. Однак якщо таке зіткнення відбувається, то воно є абсолютно пружним. В останньому випадку сумарний імпульс частинок і їх кінетична енергія зберігаються.
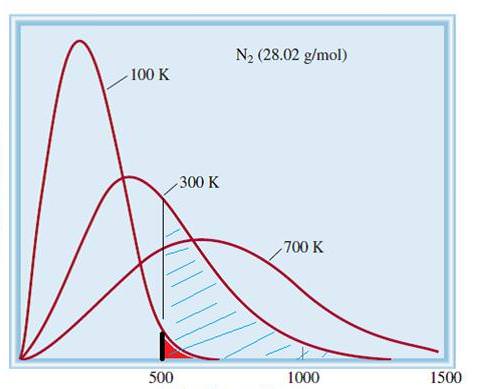
Розглянута модель ідеальних газів є класичною системою з величезним числом елементів. Тому швидкості і енергія частинок в ній підкоряються статистичному розподілу Максвелла-Больцмана. Одні частинки мають малі швидкості, інші – великі. При цьому існує певний вузький межа швидкостей, в якому лежать найбільш ймовірні значення цієї величини. Графік розподілу молекул азоту за швидкостями схематично показаний нижче.
Кінетична теорія газів
Описана вище модель ідеальних газів властивості газів визначає однозначно. Вперше ця модель була запропонована Данилом Бернуллі в 1738 році.

Згодом її розвинули до сучасного стану Серпень Крениг, Рудольф Клаузіус, Михайло Ломоносов, Джеймс Максвелл, Людвіг Больцман, Маріан Смолуховский та інші вчені.
Кінетична теорія сипучих субстанцій, на підставі якої побудовано модель ідеального газу, пояснює два важливих макроскопічних властивості системи на підставі мікроскопічного поведінки:
- Тиск в газах є результатом зіткнення частинок зі стінками посудини.
- Температура в системі – це результат прояву постійного руху молекул і атомів.
Розкриємо детальніше обидва виведення кінетичної теорії.
Тиск газу
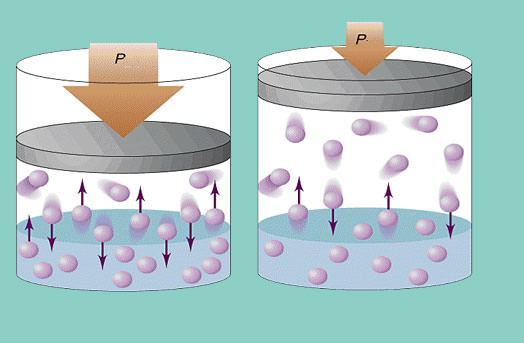
Модель ідеального газу передбачає постійне хаотичне переміщення частинок в системі і їх постійне зіткнення зі стінками посудини. Кожне таке зіткнення вважається абсолютно пружним. Маса частинки невелика (≈10-27-10-25 кг). Тому створити великий тиск при зіткненні вона не може. Тим не менш кількість частинок, а значить, і зіткнень величезна (≈1023). Крім того, середня квадратична швидкість елементів становить кілька сотень метрів в секунду при кімнатній температурі. Все це призводить до створення на стінки посудини відчутного тиску. Його можна обчислити за такою формулою:
P = N * m * vcp2 / (3 * V),
де vcp – середня квадратична швидкість, m – маса частинки.
Абсолютна температура
Відповідно до моделі ідеального газу, температура однозначно визначається середньою кінетичною енергією молекули або атома в досліджуваної системі. Можна записати наступний вираз, який пов’язує кінетичну енергію і абсолютну температуру для ідеального газу:
m * vcp2 / 2 = 3 / 2 * kB * T.
Тут kB – константа Больцмана. З цієї рівності отримуємо:
T = m * vcp2 / (3 * kB).
Універсальне рівняння стану
Якщо об’єднати записані вище вирази для абсолютного тиску P і абсолютної температури T, то можна записати наступне рівняння:
P * V = n * R * T.
Тут n – це кількість речовини в молях, R – газова константа, введена Д. І. Менделєєвим. Цей вираз є найважливішим рівнянням теорії ідеальних газів, оскільки воно об’єднує три термодинамічних параметра (V, P, T) і не залежить від хімічних особливостей газової системи.

Універсальне рівняння вперше було виведено експериментальним шляхом французьким фізиком Емілем Клапейроном в XIX столітті, а потім приведений до сучасної формі російським хіміком Менделєєвим, тому в даний час воно носить прізвища цих вчених.