Осадження — це створення твердої речовини з розчину. Спочатку реакція відбувається в рідкому стані, після чого утворюється певна субстанція, яка і називається «осадом». Хімічний компонент, що викликає його освіту, має такий науковий термін, як «осадитель». Без достатньої сили тяжіння (відстоювання), щоб звести тверді частинки разом, осад залишається в суспензії.
Після осадження, особливо при використанні центрифуги для пресування в компактну масу, осад можна назвати «гранулой». Він може бути використаний в якості середовища. Залишилася над твердим речовиною рідина без опадів називається «супернатант». Осадження — це порошки, отримані з залишкових порід. Вони також історично були відомі як «квіти». Коли тверда речовина з’являється у формі целюлозних волокон, які пройшли хімічну обробку, цей процес часто називають регенерацією.
Розчинність елемента
Іноді утворення осаду вказує на виникнення будь-якої хімічної реакції. Якщо осадження з розчинів нітрату срібла виливають у рідину хлориду натрію, то відбувається хімічна рефлексія з утворенням білого осаду з дорогоцінного металу. Коли ж рідкий йодид калію реагує з розчином нітрату свинцю (II), утворюється жовтий осад иодида свинцю (II).
Осадження може статися, якщо концентрація сполуки перевищує його розчинність (наприклад, при змішуванні різних компонентів або зміні їх температури). Повне осадження може відбуватися швидко тільки з пересиченого розчину.
В твердих речовинах процес відбувається, якщо концентрація одного продукту вище межі розчинності в іншому тілі-господаря. Наприклад, з-за швидкого охолодження або іонної імплантації температура досить висока, щоб дифузія могла призвести до розділення речовин і утворення осаду. Повне осадження в твердих тілах звичайно використовується для синтезу нанокластерів.
Перенасичення рідини
Важливий етап процесу осадження — це початок зародження. Створення гіпотетичної твердої частинки включає в себе формування кордону розділу, які, звичайно ж, вимагають деякої енергії, заснованої на відносному поверхневому русі твердого тіла, так і розчину. Якщо відповідна структура зародкоутворення недоступна, відбувається перенасичення.
Приклад осадження: мідь з дроту, яка витісняється сріблом у розчин нітрату металу, в який вона занурюється. Звичайно ж, після цих експериментів твердий матеріал випадає в осад. Реакції осадження можуть бути використані для отримання пігментів. А також для видалення солей з води при її обробці і в класичному якісному неорганічному аналізі. Саме так відбувається осадження міді.
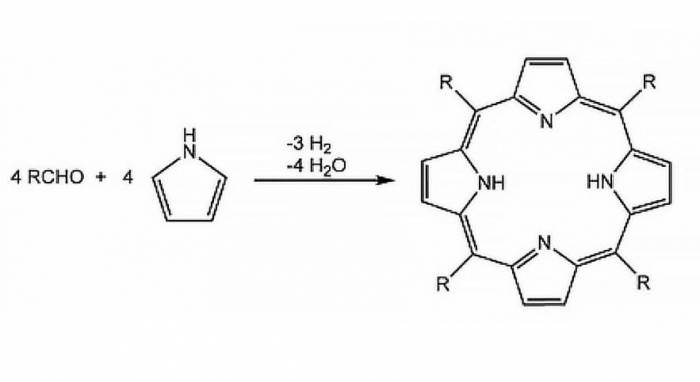
Кристали порфірину
Опади також корисні під час виділення продуктів реакції, коли відбувається обробка. В ідеалі дані речовини нерозчинні у реакційному компоненті.
Таким чином тверда речовина випадає в осад у міру його утворення, переважно створюючи чисті кристали. Прикладом цього може служити синтез порфіринів у киплячій пропіонової кислоти. При охолодженні реакційної суміші до кімнатної температури кристали цього компонента випадають на дно посудини.
Осадження опадів також може відбуватися при додаванні антирастворителя, що різко знижує абсолютну водність бажаного продукту. Після цього тверда речовина можна легко відокремити фільтрацією, декантірованіем або центрифугуванням. Прикладом може служити синтез хлориду хрому тетрафенилпорфирина: вода додається до реакційного розчину ДМФА, і продукт осідає. Осадження також корисно при очищенні усіх компонентів: неочищений пильнуємо-cl повністю розпадається в ацетонітрилі і скидається в етилацетат, де він осідає. Ще одним важливим застосуванням антирастворителя є осадження этаноломиз ДНК.
У металургії осадження з твердого розчину також є корисним способом зміцнення сплавів. Цей процес розпаду відомий як зміцнення твердого компонента.
Подання з використанням хімічних рівнянь
Приклад реакції осадження: водний нітрат срібла (AgNO 3) додають до розчину, що містить хлорид калію (KCl), спостерігається розпад твердого білого речовини, але вже срібла (AgCl).
Він, у свою чергу, утворив сталевий компонент, який спостерігається у вигляді осаду.
Ця реакція осадження може бути записана з акцентом на диссоційовані молекули в об’єднаному розчині. Це називається іонним рівнянням.
Останній спосіб створення такої реакції відомий як чиста зв’язок.
Опади різних кольорів
Зелені і червонувато-коричневі плями на зразку керна вапняку відповідають твердим речовинам оксидів і гідроксидів Fe 2+ та Fe 3+.
Багато сполуки, що містять металеві іони, проводять опади з відмінними квітами. Нижче наведені типові відтінки для різних осаждений металів. Однак багато з цих сполук можуть давати кольори, що сильно відрізняються від перерахованих.
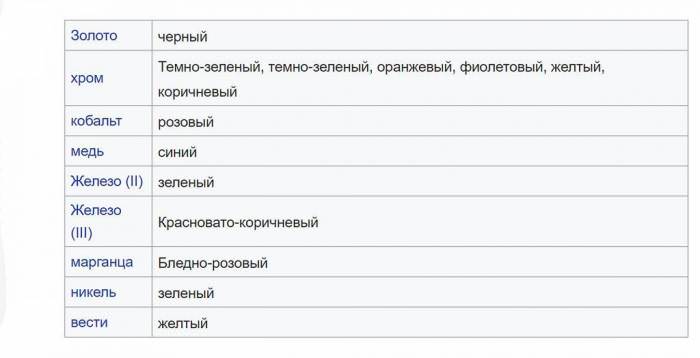
Інші об’єднання зазвичай утворюють білі опади.
Аніонний і катіонний аналіз
Утворення осаду корисно при виявленні типу катіона в солі. Для цього луг спочатку реагує з невідомим компонентом з утворенням твердого речовини. Це осадження гідроксиду даної солі. Для ідентифікації катіона відзначають колір осаду і його розчинність в надлишку. Подібні процеси часто використовуються в послідовності, наприклад, суміш нітрату барію буде реагувати з сульфат-іонами з утворенням твердого осаду сульфату барію, що вказує на ймовірність того, що другі речовини присутні в достатку.
Процес травлення
Старіння осаду відбувається, коли в розчині, з якого він випадає, залишається тільки що утворився компонент, зазвичай при більш високій температурі. Це призводить до більш чистим і великим осаждениям частинок. Фізико-хімічний процес, що лежить в основі травлення, називається дозріванням за Оствальду. Тут можна навести як приклад осадження білків.
Дана реакції відбуваються, коли катіони і аніони в гидрофитном розчині з’єднуються з утворенням нерозчинного гетерополярного твердого елемента, названого осадом. Відбувається така реакція або відсутня, можливо встановити, застосовуючи принципи водності для загальних молекулярних твердих речовин. Оскільки не всі водні реакції утворюють опади, необхідно ознайомитися з правилами розчинності, перш ніж визначати стан продуктів і писати сумарна іонне рівняння. Можливість прогнозувати ці реакції дозволяє вченим визначати, які присутні іони в розчині. А також це допомагає промисловим підприємствам утворювати хімічні речовини шляхом вилучення компонентів з цих реакцій.
Властивості різних опадів
Вони являють собою нерозчинні іонні тверді продукти реакції, які утворюються при об’єднанні певних катіонів і аніонів у водному розчині. Визначальні фактори утворення осаду можуть змінюватись. Деякі реакції залежать від температури, наприклад, розчини, які використовуються для буферів, тоді як інші мають зв’язок тільки з концентрацією розчину. Тверді речовини, які утворюються в реакціях осадження, є кристалічними компонентами і можуть бути суспензированы у всієї рідини або впасти на дно розчину. Вода, що залишилася, називається надосадової. Два елемента консистенції (осад і супернатант) можуть бути розподілені різними методами, такими як фільтрування, ультрацентрифугування або зціджування.
Взаємодія осадження і подвійної заміни
Застосування законів розчинності вимагає подання того, як реагують іони. Велика частина взаємодій осадження являють собою процес однократного заміщення або подвійного. Перший варіант відбувається тоді, коли два іонних реагенту дисоціюють і зв’язуються з відповідним аніоном або катіоном іншої речовини. Молекули замінюють один одного на основі своїх зарядів у вигляді катіона або аніона. Це можна розглядати як «перемикання партнерів». Тобто кожен з двох реагентів «втрачає» свого компаньйона і утворює зв’язок з іншим, так, наприклад, відбувається хімічне осадження сірководнем.
Реакція подвійної заміни конкретно класифікується як процес затвердіння, коли розглянуте хімічне рівняння виникає у водному розчині, і один з продуктів, що утворилися, є нерозчинним. Приклад такого процесу приведено нижче.
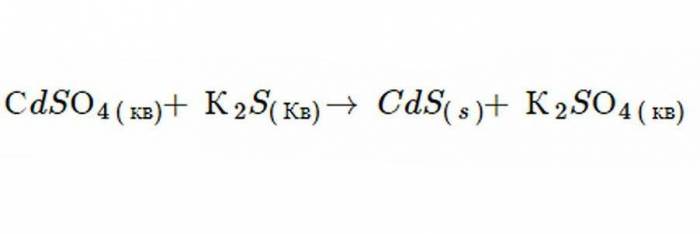
Обидва реагенту є водними і один продукт – твердим. Оскільки всі компоненти іонні і рідкі, вони дисоціюють і тому можуть повністю розчинятися один в одному. Однак існує шість принципів водності, які використовуються для прогнозування того, які молекули нерозчинні при осадженні у воді. Ці іони утворюють твердий осад у загальній суміші.
Правила розчинності, швидкість осадження
Чи є реакція утворення осаду диктованих правилом водності речовин? Насправді всі ці закони і здогадки надають керівні вказівки, які повідомляють, які іони утворюють тверді речовини, а які залишаються в їх первісної молекулярній формі у водному розчині. Правила повинні дотримуватися зверху вниз. Це означає, що, якщо щось нерозв’язне (або розв’язується) з-за вже першого постулату, воно має пріоритет над наступними вказівками з більш високим порядковим номером.
Броміди, хлориди і йодиди розчиняються.
Солі, що містять осадження срібла, свинцю і ртуті, неможливо змішати повністю.

Якщо в правилах зазначено, що молекула розчинна, то вона залишається у водній формі. Але якщо компонент є несмешиваемым у відповідності з законами та постулатами, описаними вище, то він утворює тверду речовину з предметом або рідиною з іншого реагенту. Якщо показано, що всі іони у якої-небудь реакції розчинні, то процес осадження не відбувається.
Чисті іонні рівняння
Щоб зрозуміти визначення цього поняття, необхідно згадати закон для реакції подвійної заміни, який був наведений вище. Оскільки ця конкретна суміш є методом осадження, стану матерії можуть бути призначені для кожної змінної пари.
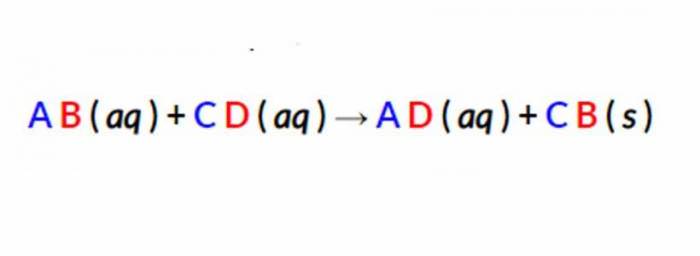
Першим кроком до написання чистого іонного рівняння є поділ розчинних (водних) реагентів і продуктів на їх відповідні катіони і аніони. Опади не розчиняються у воді, тому тверда речовина не повинно відділятися. Отримане правило виглядає наступним чином.

У наведеному вище рівнянні іони A+ і D – присутні з обох сторін формули. Їх ще називають молекулами-глядачами, тому що вони залишаються незмінними протягом всієї реакції. Оскільки саме вони проходять через рівняння без змін. Тобто їх можна виключити, щоб показати формулу бездоганною молекули.
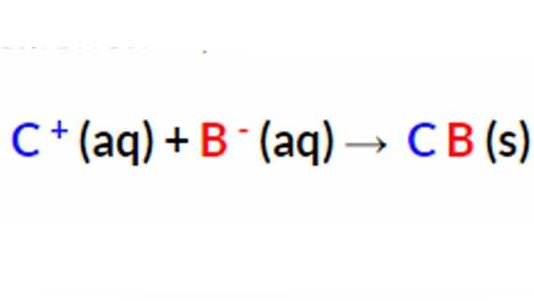
Чисте іонне рівняння показує тільки реакцію осадження. А мережева молекулярна формула обов’язково повинна бути збалансована з обох сторін не тільки з точки зору атомів елементів, але і якщо розглядати їх з боку електричного заряду. Реакції опадів зазвичай представлені виключно йонними рівняннями. Якщо всі продукти є водними, чиста молекулярна формула не може бути записана. А відбувається це тому, що всі іони виключені як продукти глядача. Тому ніякої реакції осадження, природно, не відбувається.
Додатки і приклади
Реакції осадження корисні при визначенні того, чи є той самий необхідний елемент в розчині. Якщо осад утворюється, наприклад, коли хімічна речовина вступає в реакцію зі свинцем, присутність цього компонента у водних джерелах може бути перевірено шляхом додавання хімічної речовини та контролю утворення осаду. Крім того, рефлексія осадження може бути використана для вилучення елементів, таких як магній, з морської води. Реакції опадів навіть відбуваються в організмі людини між антитілами та антигенами. Однак середовище, в якій це трапляється, все ще вивчається вченими з усього світу.
Перший приклад
Необхідно завершити реакцію подвійної заміни, а потім звести її до рівняння чистого іона.
По-перше, необхідно передбачити кінцеві продукти цієї реакції, використовуючи знання про процес подвійної заміни. Для цього потрібно пам’ятати, що катіони і аніони «перемикають партнерів».
По-друге, варто розділити реагенти на їх повноцінні іонні форми, оскільки вони існують у водному розчині. І також не варто забувати збалансувати як електричний заряд, так і загальна кількість атомів.
Нарешті, треба включити всі іони глядача (ті самі молекули, які зустрічаються по обидва боки формули, які не змінилися). В даному випадку це такі речовини, як натрій і хлор. Кінцеве іонне рівняння виглядає так.
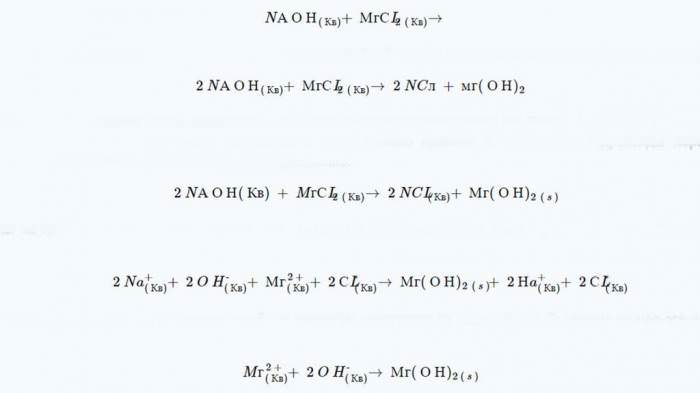
Необхідно також завершити реакцію подвійної заміни, а потім знову ж обов’язково звести її до рівняння чистого іона.
Загальне рішення задач
Передбаченими продуктами цієї реакції є CoSO4 і NCL з правил розчинності, COSO4 повністю розпадається, бо пункт 4 говорить, що сульфати (SO2–4) не осідають у воді. Точно так само потрібно виявити, що компонент NCL дозволимо на основі постулату 1 і 3 (в якості доказу можна навести тільки перший уривок). Після балансування отримане рівняння має наступний вигляд.
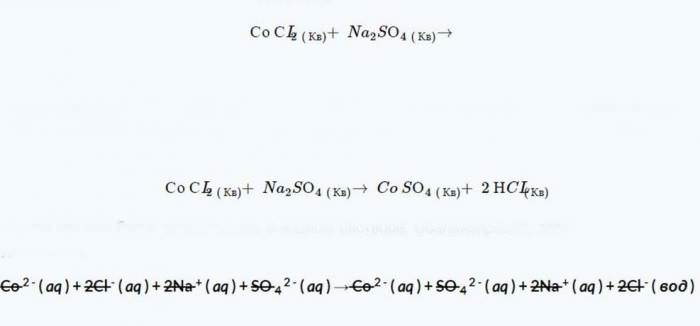
Для подальшого кроку варто розділити всі компоненти на їх іонні форми, так як вони будуть існувати у водному розчині. А також збалансувати заряд і атоми. Після чого скасувати всі іони глядача (ті, які з’являються як компоненти з обох сторін рівняння).
Немає реакції опадів
Цей конкретний приклад важливий, тому що всі реагенти і продукти є водними, що означає, що вони виключаються з чистого іонного рівняння. Там не утворюється твердого осаду. Отже, ніякої реакції осадження не відбувається.
Необхідно написати сумарна іонне рівняння для потенційно подвійних реакцій зміщення. Обов’язково варто включити в рішення стан матерії, це допоможе досягти балансу в загальній формулі.
Рішення
1. Незалежно від фізичного стану, продукти цієї реакції є Fe(ОН)3 і NO3. Правила розчинності передбачають, що NO3 повністю розпадається в рідині, тому що всі нітрати є такими (це доводить другий пункт). Тим не менш Fe (Н)3 не розчиняється, тому що осадження іонів гідроксидів завжди мають таку форму (в якості доказу можна навести шостий постулат) і Fe не є одним з катіонів, що призводить до виключення компонента. Після дисоціації рівняння має наступний вигляд:
2. В результаті реакції подвійної заміни продукти являють собою Al, CL3 і Ba, SO4, AlCL3 розчинний, тому що містить хлорид (правило 3). Однак B a S О4 не розпадається в рідині, так як компонент має в своєму складі сульфат. Але В 2 + іон робить його також нерозчинним, тому що це один з катіонів, який викликає виключення з четвертого правила.
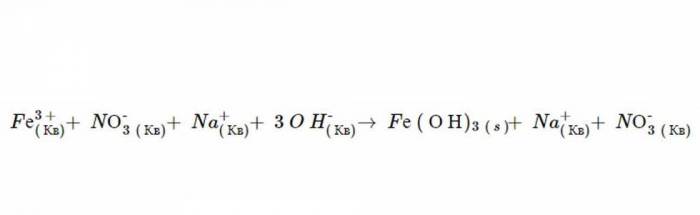
Саме так виглядає кінцеве рівняння після балансування. А при видаленні глядацьких іонів виходить вже наступна мережева формула.
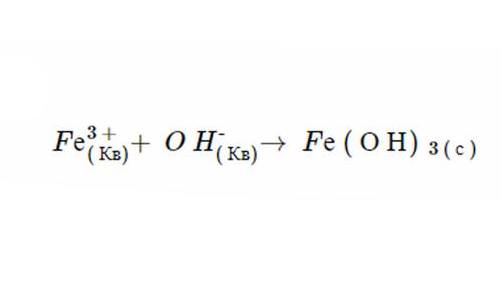
3. З реакції подвійної заміни, продукти HNO3, а також ZnI2 утворюються. Згідно з правилами, HNO3 розпадається, тому що містить нітрат (другий постулат). І Zn I2 також розчинний, тому що йодиди є такими ж (пункт 3). Це означає, що обидва продукти є водними (тобто дисоціюють у будь рідини) і таким чином ніякої реакції осадження не відбувається.
4. Продуктами цієї подвійної рефлексії заміщення є C a3(РО4)2 і N CL. Правило 1 свідчить, що N CL розчинний, і відповідно з шостим постулатом, C a3(РО4)2 не розпадається.
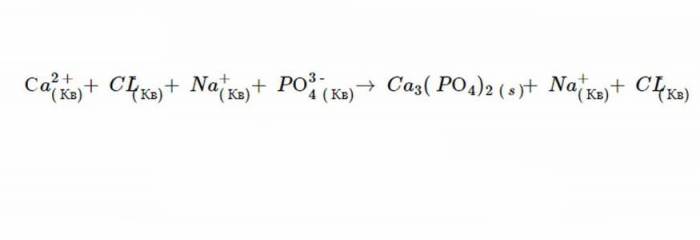
Саме такий вигляд матиме іонне рівняння, коли реакція завершиться. А після виключення осаждений виходить ось така формула.
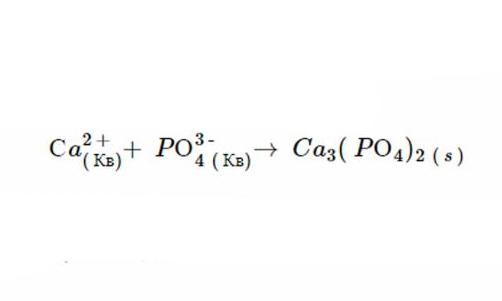
5. Перший продукт цієї реакції, PbSO4, розчинний у відповідності з четвертим правилом, тому що це сульфат. Другий продукт KNO3 також розпадається в рідині, тому що містить нітрат (другий постулат). Тому ніякої реакції осадження не відбувається.
Хімічний процес
Дана дія відділення твердої речовини при осадженні з розчинів, що відбувається або шляхом перетворення компонента в нераспадающуюся форму, або шляхом зміни складу рідини, щоб зменшити якість предмета в ньому. Відмінність між осадженням і кристалізацією в значній мірі полягає в тому, що робиться акцент на процесі, за допомогою якого розчинність зменшується, або на те, завдяки чому структура твердого речовини стає організованою.
У деяких випадках селективні опади можуть бути використані для видалення перешкод суміші. До розчину додають хімічний реагент, і він вибірково реагує з інтерференцією, утворюючи осад. Потім його можна фізично відокремити від суміші.
Опади часто використовуються для видалення металевих іонів з водних розчинів: іони срібла, присутні в рідкому сольовому компоненті, такому як нітрат срібла, який осаджують додаванням молекул хлору, при умові, наприклад, що буде використаний натрій. Іони першого компонента і другого об’єднуються, утворюючи хлорид срібла, з’єднання, яке не розчиняється у воді. Точно так само молекули барію перетворюються при осадженні кальцію оксалатом. Були розроблені схеми для аналізу сумішей іонів металів шляхом послідовного застосування реагентів, які осаджують конкретні речовини або їх пов’язані групи.
У багатьох випадках можна вибрати будь-умови, при яких речовина осідає в дуже чистою і легко відокремлюваним формі. Виділення таких опадів та визначення їх маси являють собою точні методи осадження, знаходження кількості різних сполук.
При спробах відділення твердої речовини з розчину, який містить кілька компонентів, небажані складові часто включаються в кристали, що знижує їх чистоту і погіршує точність аналізу. Таке забруднення можна зменшити, виконуючи операції з розведеними розчинами і повільно додаючи осаждающий агент. Ефективна техніка називається гомогенним осадженням, при якому він синтезується в розчині, а не додається механічно. У важких випадках може виникнути необхідність ізолювати забруднену осад, повторно розчинити його, і також осадити. Велика частина заважаючих речовин видаляється у вихідному компоненті, а друга спроба проводиться при їх повній відсутності.
Крім того, назву реакції дається по твердому компоненту, яке утворюється в результаті реакції осадження.
Щоб вплинути на розпад речовин в з’єднанні, необхідний осад з утворенням нерозчинного з’єднання, або створений шляхом взаємодії двох солей або зміни температури.
Дане осадження іонів може вказувати на те, що відбулася хімічна реакція, але це також може статися, якщо концентрація розчиненої речовини перевищує його частку повного розпаду. Дія передує події, званому зародышеобразованием. Коли невеликі нерозчинні частинки агрегує один з одним або утворюють верхню частину розділу з поверхнею, такий як стінка контейнера або затравочний кристал.
Ключові висновки: визначення опадів в хімії
В цій науці, даний компонент є і дієсловом і іменником. Осадження – це освіта деякого нерозчинного з’єднання або шляхом зниження повного розпаду суміщення, або через взаємодії двох сольових компонентів.
Тверде речовина виконує важливу функцію. Так як вона утворюється в результаті реакції осадження і називається осадом. Тверде речовина використовується для очищення, видалення або вилучення солей. А також для виготовлення пігментів і ідентифікації речовин в якісному аналізі.
Осад проти осадження, понятійний апарат
Термінологія може здатися трохи заплутаною. Ось як це працює: освіта твердої речовини з розчину називається осадом. А хімічний компонент, який пробуджує жорсткий розпад в рідкому стані, іменується осадителем. Якщо розмір часток нерозчинної сполуки дуже малий або сили тяжіння недостатні для витягування кристалічного компонента на дно контейнера, осад може бути рівномірно розподілений по рідини, утворюючи суспензію. Седиментація відноситься до будь-якої процедури, яка відділяє осад від водної частини розчину, яка називається супернатантом. Поширеним методом седиментації є центрифугування. Як тільки осад витягнутий, отриманий порошок можна назвати «квіткою».
Ще один приклад утворення зв’язку
Змішування нітрату срібла, хлориду натрію у воді викличе випадання хлориду срібла з розчину у вигляді твердої речовини. Тобто в цьому прикладі осад являє собою ХС.
При написанні хімічної реакції присутність випадіння може бути позначено наступної наукової формулою зі стрілкою вниз.
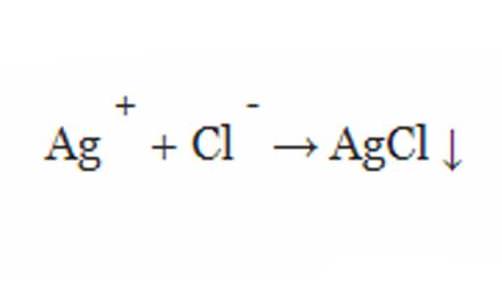
Використання опадів
Дані компоненти можуть бути використані для ідентифікації катіони або аніони в солі як частина якісного аналізу. Відомо, що перехідні метали утворюють різні кольори опадів в залежності від їх елементарної ідентичності і ступеня окислення. Реакції осадження в основному використовуються для видалення солей з води. А також для виділення продуктів для приготування пігментів. У контрольованих умовах реакція осадження дає чисті кристали осаду. У металургії вони використовуються для зміцнення сплавів.
Як відновити осад
Є кілька метод осадження, що використовуються для вилучення твердого речовини:
Старіння опадів
Процес, званий виварювання, відбувається, коли свіжому твердому речовині дають залишатися у своєму розчині. Зазвичай температура всієї рідини підвищується. Імпровізоване травлення може виробляти більш великі частинки з високою чистотою. Процес, який приводить до цього результату, відомий як “дозрівання Оствальда”.