У сучасному світі неможливе життя без хімічних реакцій, які протікають всюди і носять як корисний, так і небезпечний характер. Згідно періодичної таблиці хімічних елементів Менделєєва Д. І., метали 1 групи головної підгрупи, в число яких входить і натрій (Na), бурхливо реагують з водою, утворюючи лугу – хімічно активні речовини.
Поняття про лугах
Розчинні у воді гідроксиди активних металів – луги – їдкі і досить небезпечні хімічні речовини. За своєю формою вони тверді, білого кольору. Розчиняючись у воді, ці підстави виділяють тепло. Також лугу здатні руйнувати шкіру, деревину, тканини, в результаті чого і отримали тривіальне назва “їдкі”, яке зазвичай застосовується тільки до гидроксидам лужних металів. До найбільш відомим лугів відносяться гідроксиди натрію (NaOH), калію (КОН), літію (LiOH), барію (Ba(OH)2), цезію (CsOH), кальцію (Ca(OH)2) і деякі інші.

Гідроксид натрію: характеристика
Їдкий натр – це тривіальна назва гідроксиду натрію – одного з найпоширеніших лугів. Вона відноситься до небезпечних хімічних речовин, тому що легко роз’їдає шкіру людини, тому потрібно дотримуватися необхідних заходів безпеки при роботі з нею. Також гідроксид натрію іноді називають каустичною содою, або каустиком. Як і всі інші луги, він добре взаємодіє з водою з виділенням тепла і являє собою біле, гігроскопічна, тобто здатне поглинати водяні пари з повітря, що з’єднання. Щільність їдкого натру становить 2,13 г/см3.

Реакційна здатність
Розчин їдкого натру може вступати в реакції різного типу, утворюючи інші речовини.
1. При взаємодії цього з’єднання з кислотами завжди утворюються сіль і вода:
NaOH + HCl = NaCl2 + H2O.
2. Їдкий натр здатний реагувати з кислотними та амфотерними оксидами металів (в розчині і при сплавленні), також утворюючи відповідну сіль і воду:
- 2NaOH + SO3 = Na2SO4 + H2O (SO3 – кислотний оксид);
- 2NaOH + ZnO = Na2ZnO2 + H2O (ZnO – амфотерний оксид, дана реакція проходить при сплавці і нагріванні).
При взаємодії гідроксиду натрію з розчином амфотерного оксиду утворюється розчинна комплексна сіль.
3. Реакція лугу з амфотерними гідроксидами також призводить до утворення розплаву або комплексної натрієвої солі в залежності від умов її проведення.
4. Шляхом взаємодії каустику з солями отримують натрієві і відповідний нерозчинний у воді гідроксид.
- 2NaOH + MgCl2 = 2NaCl + Mg(OH)2 (гідроксид магнію – нерозчинна у воді підстава).
5. Гідроксид натрію здатний реагувати і з неметалами, наприклад, із сіркою або галогенами з утворенням суміші натрієвих солей, а також з амфотерними металами з утворенням комплексних солей, залізом і міддю.
- 3S + 6NaOH = 2Na2S + Na2SO4 + 3H2O.
6. Їдкий натр здатний вступати у взаємодію і з органічними речовинами, наприклад: ефірами, амідами, багатоатомними спиртами.
- 2C2H6O2 + 2NaOH = C2H4O2Na2 + 2H2O (продукт реакції – алкоголят натрію).

Отримання
Існує кілька методів одержання їдкого натру в промисловості, основними з яких є хімічні і електрохімічні.
В основу першого методу входять кілька способів: піроліз, вапняний і феритний.
1. Піроліз проводиться при прожарюванні карбонату натрію при високій температурі (не менше 1000 градусів) з утворенням оксиду натрію і вуглекислого газу. Далі одержаний охолоджений оксид розчиняють у воді, внаслідок чого і виходить їдкий натр.
- Na2CO3 = Na2O + CO2 (при 1000 градусів);
- Na2O + H2O = 2NaOH.
Іноді замість карбонату натрію використовують його гідрокарбонат, і процес, відповідно, проходить трохи складніше.
2. Вапняний метод отримання гідроксиду натрію полягає у взаємодії натрієвої солі вугільної кислоти з гідроксидом кальцію (гашеним вапном) при нагріванні до температури не менше 80 градусів. В результаті такої взаємодії виходять розчини лугу і карбонату кальцію (CaCO3), який потім фільтрується від основного розчину.
- Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3.
3. Феритний метод проводиться в два етапи: спочатку здійснюється сплавлення соди з оксидом заліза III при температурі до 1200 градусів для отримання фериту натрію, потім останній обробляють водою, в результаті чого виходить луг.
- Na2CO3 + Fe2O3 = 2NaFeO2 + CO2;
- 2NaFeO2 + 2H2O = 2NaOH + Fe2O3*H2O.
При електрохімічному метод одержання їдкого натру також застосовуються декілька способів: електроліз розчину кухонної солі (NaCl), діафрагмовий, мембранний і ртутний метод з рідким катодом. Останні три способи є більш складними в порівнянні з першим, але всі вони пов’язані з пропусканням через розчин відповідних солей електричного струму, тобто з електролізом.
Найпоширеніший метод отримання лугу – електроліз розчину галіту, що складається з кухонної солі, в результаті чого на аноді і катоді виділяються хлор і водень, і виходить гідроксид натрію:
- 2NaCl + 2H2O = H2 + Cl2 + 2NaOH.
В лабораторії каустичну соду також отримують хімічними способами, але найчастіше використовуються діафрагмовий і мембранний методи.

Застосування
Їдкий натр знаходить застосування не тільки у різних галузях промисловості, але і в побуті. Його застосовують:
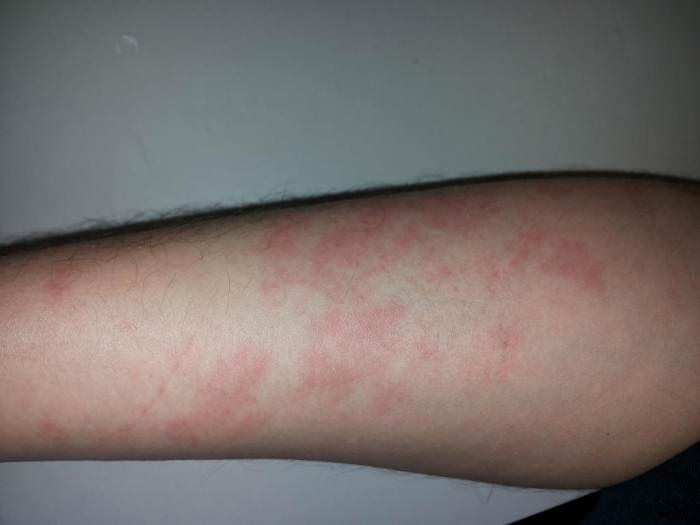
Запобіжні заходи
Їдкий натр – сильне підставу. Воно може легко пошкодити не тільки тканина, але і шкіру людини, що буде супроводжуватися опіками. При роботі з цією речовиною необхідно дотримувати певні заходи безпеки, а саме:
- Необхідно носити спеціальні гумові рукавички, окуляри для запобігання попадання розчину на руки і очі.
- Потрібно ходити в одязі, яка буде стійка до хімічних сполук і не дозволить їм потрапити на шкіру тіла. Зазвичай такий одяг оброблена полівінілхлоридом.