Хімія – один з найважливіших предметів у школі. Дивовижний світ речовин і сполук, а також барвисті і цікаві досліди, які показує викладач, зачаровують всіх дітей, змушуючи виявляти певний інтерес до таємничої науки. У даній статті звернемо увагу на процес електролітичної дисоціації, а конкретніше на слабкі і сильні електроліти.
Щоб дати розгорнуту відповідь на питання, що ж відноситься до сильних електролітів, а що – до слабких, треба для початку розібратися, що таке дисоціація речовин.

Електролітична дисоціація
Різні хімічні сполуки, наприклад, солі або кислоти розчиняються у воді, розпадаючись до елементарних частинок: іонів, цю реакцію і прийнято називати електричної дисоціацією. Сполуки, що розчиняються, розпадаючись на іони, у свою чергу називаються електролітами.
Так ще називаються сполуки, здатні проводити електричний струм, а речовини, які не наділені цією здатністю, відповідно, називають неелектролітами.
Процес дисоціації є оборотним, тому на письмі позначається двома стрілками з протилежними напрямками, написаними один під одним. Отриманий розчин має здатність проведення електричного струму.
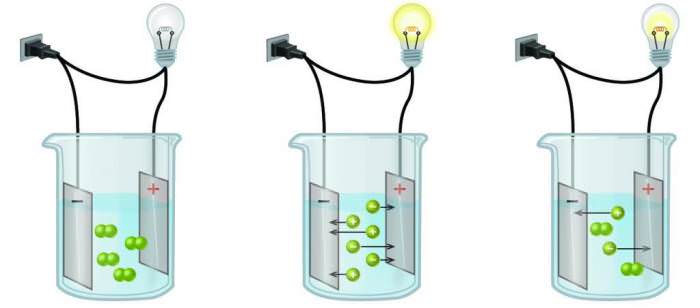
Електричний струм – це скоординований рух вільних частинок, що володіють зарядом, що має певний напрям. Електричний струм в металах проходить за допомогою відносно вільних електронів, але в даному випадку мова піде не про метали.
Крім того, іони, на які розпалося речовина мають різний заряд. Тут необхідно ввести ще два терміни по даній темі: катіони і аніони. Катіони – це іони з позитивним зарядом, а аніони ж навпаки – з негативним.
Кількісна характеристика процесу
Так як в подальшому мова йтиме саме про водних сполученнях, то необхідно ввести поняття розчин. Згідно фізичної теорії, розчин – це механічна частина складових без будь-якого допустимого взаємодії молекул. Проте, даючи відповідь на питання, що відноситься до сильних електролітів, дана версія не має пояснення для електролітичних розчинів. Тому звернемося до хімічного погляду на дане поняття.
Розчин представляє собою хімічну реакцію, що підтверджується, наприклад, виділенням тепла або зміною кольору розчину, між розчинником (в даному випадку вода) і розчиненому в ньому речовині (в даному випадку електроліт). Сучасна наука вважає, що це поняття можна характеризувати як фізичним, так і хімічним визначенням, адже обоє вони по суті є вірними.

Для того щоб кількісно характеризувати дисоціацію різних сполук, було вирішено використовувати поняття “електролітична ступінь дисоціації речовини”, що допомагає зрозуміти, які речовини відносяться до сильних електролітів, а які – до слабких. Це характеризує число обчислюється за формулою як приватне кількість розпалися на іони молекул до сумарної їх кількості в речовині. Відповідно, якщо це значення наближене до одиниці, то з’єднання відноситься до сильних електролітів, так як переважна більшість молекул пройшли дисоціацію. Як правило, у хімічних реакціях з сильними електролітами прийнято писати знак “дорівнює”, так як вона не є оборотною.
Сильні електроліти
До сильних електролітів належать:
- Солі, розчинні у воді. Цю інформацію можна отримати, відкривши таблицю розчинності.
- Неорганічні кислоти, що відносяться до сильних електролітів, такі як H2SO4, HCl, HNO3 та інші.
- Гідроксиди сполук металів, а також підстави, такі як LiOH, Ba(OH)2 та інші.
Слабкі електроліти
Визначившись, що відноситься до сильних електролітів, варто поговорити і про їх протилежності – слабких електролітів, погано диссоциирующихся у воді.
До них відноситься:
- Неорганічні кислоти, такі як h 2 co 3, H2S, HNO2 та інші.
- Багато органічні кислоти.
- Гідроксиди металів, які не розчиняються у воді. Інформацію про це можна дізнатися, відкривши таблицю розчинності.
- Вода.
Висновок
Будемо сподіватися, що ця стаття виявилася вам корисною, і ви отримали розгорнуту відповідь на питання, що відноситься до сильних електролітів, а що – до слабких. У будь-якому випадку хочемо вам побажати успіхів у подальшому вивченні дивного світу хімії, який може здатися магією тільки в самому початку. А при подальшому навчанні ви самостійно зможете творити чудеса, дивуючи всіх навколо себе.












